|
El Consejo de Ministros aprueba un decreto de
ayudas económicas para 130 víctimas de la talidomida, un fármaco
para embarazadas que hace varias décadas causó miles de casos
de malformaciones en 50 países, según ha informado el Ministerio
de Derechos Sociales y Agenda 2030. Según el departamento
de Ione Belarra, este decreto “busca hacer justicia con los
afectados en España, uno de los países que más ha tardado
en prestarles apoyo”. Para ello, establece una serie de ayudas
económicas que recibirán 130 personas, tras la evaluación
llevada a cabo por parte del Instituto Carlos III de Madrid,
la entidad sanitaria que se ha encargado de analizar los casos
y calcular los importes a percibir en función del grado de
discapacidad sufrido como consecuencia de la exposición al
medicamento.
Para una persona con un 33% de discapacidad,
la ayuda ascenderá a 396.000 euros en un pago único, a razón
de 12.000 euros por cada punto fijado en el protocolo, y según
fue establecido en una disposición adicional de la Ley de
Presupuestos Generales del Estado (PGE) de 2018. Las ayudas
podrán solicitarse desde la publicación del decreto en el
BOE y su gestión correrá a cargo del Instituto de Mayores
y Servicios Sociales (Imserso), dependiente del Ministerio
de Derechos Sociales, informa Efe. La talidomida fue un fármaco
que se comercializó en los años cincuenta y sesenta del siglo
pasado como calmante de las náuseas en los primeros meses
de embarazo y que provocó miles de casos de malformaciones
en los fetos.

En España, el franquismo optó por silenciar
el asunto y negó que el medicamento se hubiera utilizado en
España, a pesar de que posteriormente se ha reconocido su
comercialización y prescripción al menos entre 1959 y 1965.
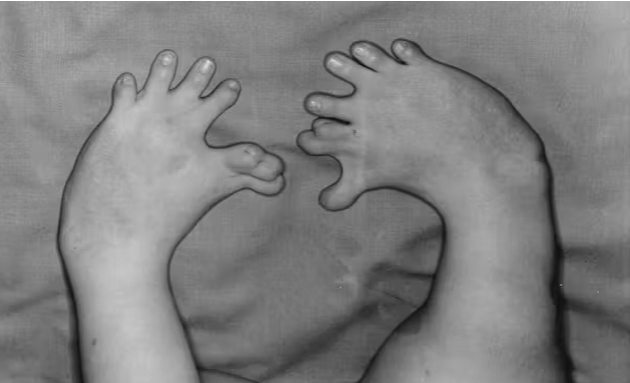
La principal malformación fue la focomelia, una anomalía congénita
caracterizada por la carencia o excesiva cortedad de las extremidades.
Hasta la fecha, solo 24 víctimas habían recibido ayudas, de
acuerdo con una disposición de los Presupuestos de 2009, pero
ese intento de reparar a las víctimas, sin embargo, se enfrentó
a serios problemas para determinar la relación de afectados
por la talidomida, y por eso ahora para determinar las ayudas
se han realizado más de 600 análisis complejos. Según han
recordado fuentes de Derechos Sociales, en ese proceso han
participado genetistas del Sistema Nacional de Salud, sin
la colaboración de la industria farmacéutica ni de empresas
privadas, y han diseñado un panel de genes único en el mundo.
La Asociación de Víctimas de la Talidomida en
España (Avite), que representa a más de la mitad de los afectados
que recibirán las ayudas, se reunió hace mes y medio con representantes
de la Fiscalía para pedir la apertura de una investigación
por si cabía prevaricación del Gobierno al no haberse concedido
aún las ayudas tras su aprobación en los Presupuestos hace
cinco años. Aunque no existen estimaciones precisas del número
total de afectados en el mundo, las más aceptadas sitúan la
cifra en cerca de 10.000 en medio centenar de países, la mitad
de los cuales fallecieron en los primeros meses de vida. Según
datos de Avite, Alemania ha reconocido a casi 3.000 víctimas
y el Reino Unido, cerca de medio millar. Según el Ministerio
de Sanidad, un total de 609 personas solicitaron en España
someterse al proceso de evaluación de anomalías congénitas,
de las que finalmente 130 resultaron ser compatibles con la
talidomida.
--------------------------------------------------------------------------------------------------------------

--------------------------------------------------------------------------------------------------------------
Para la mayoría de la gente alfa-N-ftalimido-glutarimida
no significa nada. No así cuando se menciona la forma apocopada
de este nombre, talidomida. Ha transcurrido más de medio siglo,
y los niños que nacieron con graves malformaciones tras la
toma del medicamento por sus madres durante su gestación,
hoy casi ancianos, son un ejemplo todavía vivo de los riesgos
asociados a la laxitud de la regulación farmacéutica. La talidomida
se sintetizó primero en Suiza en 1953 por los entonces laboratorios
Ciba; y un año después, 1954, por la farmacéutica alemana
(entonces República Federal de Alemania) Chemie Grünenthal.
La empresa germana comercializó el fármaco a partir del 1
de octubre de 1957. Se promocionó por sus propiedades sedantes,
como una alternativa más segura que los barbitúricos, prescritos
entonces como sedantes e hipnóticos. En aquella época todavía
no se habían desarrollado las benzodiacepinas. De hecho se
afirmaba que talidomida remedaba un sueño parecido al fisiológico.
Se consideró un medicamento seguro por dos razones: las sobredosis,
accidentales o deliberadas, no eran mortales (a diferencia
de los barbitúricos, muy usados con fines suicidas); y además,
no parecía dañar a las crías de hembras animales preñadas,
al menos las especies animales usadas entonces de modo rutinario
en experimentación animal (ratas, ratones y cobayas). Esta
segunda razón fue determinante para que se recomendase como
sedante y antiemético (anti-nauseoso) para prevenir las náuseas
y vómitos durante los primeros meses de gestación.

Ramón Ozamiz, afectado por la talidomida, retratado
en 2015.
Chemie Grünenthal comenzó a vender Talidomida,
bien directamente o a través de licenciatarios, en unos 40
países de todo el mundo. Se comercializó con diversos nombres
de fantasía: Contergan®, Distaral®, Softenon®, Neurosedyn®,
Telargan®, Sedalis® y Kevadon®. El 18 de noviembre de 1961,
Widukind Lenz , un genetista y pediatra de Hamburgo (entonces
República Federal de Alemania) dio a conocer a la comunidad
científica un notable incremento del número de casos de focomelia
(unas rarísimas alteraciones en recién nacidos) atendidos
en las clínicas del norte del país. Estos niños tenían muñones
en lugar de miembros. Enseguida se estableció una relación
causal entre los casos de focomelia y la toma de Talidomida
por sus madres durante el embarazo. Se supo que en determinadas
situaciones incluso una única dosis era suficiente para engendrar
un niño con gravísimas deformidades.
Apenas un mes después de la comunicación de
Widukind Lenz, un obstetra australiano, William McBride dio
cuenta de hechos similares en la lejana Australia.
El número de casos creció tan deprisa que muchos
países prohibieron el medicamento antes de finalizar ese año,
1961. Entonces, el número de niños nacidos con terribles deformidades
era de alrededor de 10.000, sobre todo en Europa, Asia y Oriente
Medio, donde el fármaco se prescribía con frecuencia.

La tragedia de la talidomida detonó la farmacovigilancia,
la ciencia y las actividades relativas a la detección, evaluación,
comprensión y prevención de las reacciones adversas o cualquier
otro problema de salud relacionado con medicamentos o vacunas.
Un estudio detallado de las historias clínicas
de los niños afectados estableció que las deformidades fetales
ocurrían cuando las embarazadas usaban el fármaco entre los
días trigésimo quinto y cuadragésimo noveno tras su última
menstruación . Durante estos días, una única dosis de Talidomida
podía desencadenar una toxicidad fetal (teratogenicidad) que
se manifestaba como focomelia (ausencia brazos y/o piernas,
con las manos y pies saliendo prácticamente del tronco a modo
de muñones); pero también ausencia de pabellones auditivos,
defectos del paladar y malformaciones esofágicas y gastrointestinales.
Aproximadamente el 40% de los recién nacidos afectados fallecían
durante el primer año de vida. En Estados Unidos, el fabricante
farmacéutico William S. Merrell (más adelante Merrell Dow)
obtuvo la licencia para comercializar Talidomida con el nombre
registrado de Kevadon®. El Organismo regulador de alimentos
y fármacos norteamericano (Food and Drug Administration) recibió
la solicitud de autorización en septiembre de 1961. William
S. Merrell había almacenado ingentes cantidades de Kevadon®
en espera de la autorización de comercialización. Simples
trámites burocráticos. Por suerte, el informe técnico cayó
en manos de Frances Oldham Kelsey, a la sazón una joven médico
de familia recién contratada para trabajar en las oficinas
de la Food and Drug Administration en Washington. Lejos de
comportarse de modo timorato, a la manera de una burócrata,
como se esperaba de ella, exigió al fabricante información
complementaria antes de firmar su conformidad. William S.
Merrell respondió a su solicitud. Sin embargo, los informes
enviados no conformaron a la doctora Kelsey, que exigió más
datos. El poderoso William S. Merrell protestó airadamente
a los responsables de la Agencia (superiores jerárquicos de
la doctora Kelsey). ¿Cómo una joven podía bloquear en los
almacenes toneladas del fármaco con enormes pérdidas económicas?
Este retraso fue trascendental. A finales del año siguiente,
1961, los informes recibidos de Europa eran alarmantes. La
autorización de medicamentos es, hoy día, una enorme responsabilidad.
Pero a mediados del siglo XX, antes de la amarga experiencia
de la talidomida, era poco más que un trámite burocrático.
El polémico fármaco volvió a nuestro
país el 2 de febrero, pero solo en farmacias hospitalarias.
Y es que sus malversos efectos secundarios siguen vigentes
en su composición. Es por ello que desde la Organización de
Consumidores y Usuarios alertan de las precauciones que han
de tomar los enfermos para prevenir embarazos. El plan de
prevención de la OCU incluye tanto a las mujeres en edad fértil
como a cualquier hombre, ya que la talidomida pasa al líquido
seminal.
La actitud valiente, casi heroica teniendo en
cuenta sus circunstancias, de Frances Oldham Kelsey , fallecida
en agosto de 2015, le hizo merecedora de la más alta condecoración
civil de Estados Unidos: fue la «Vigésima Heroína» de Estados
Unidos, reconocimiento entregado por el entonces Presidente
John Fitzgerald Kennedy. Un día antes de su óbito, ya muy
enferma, la Dra. Kelsey recibió la «Orden de Canadá», entregado
en casa de su hija, con quien vivía, en Ontario, Canadá, su
país natal. Frances Oldham Kelsey siempre insistió que su
reconocimiento debía ser compartido con dos colegas, Oyram
Jiro, farmacólogo, y Lee Geismar, químico, quienes le apoyaron
en su valiente decisión. En Estados Unidos se produjeron muy
pocos casos de malformaciones, todos ellos debidos a la entrega
directa del medicamento por el laboratorio a alrededor de
1.000 médicos. Las muestras del fármaco se entregaban teóricamente
con fines de investigación, si bien se hacía con fines promocionales.
Cuando se supo de los gravísimos riesgos, se intentaron recuperar
todos los envases de Kevadón® que el laboratorio había distribuido
entre los médicos. Aun cuando se actuó con diligencia, diecisiete
niños nacieron con deformidades.

AVITE, la asociación que representa a los afectados
por la talidomida en España, el medicamento de Grünenthal
que causó malformaciones en recién nacidos en los años 50
y 60, presentó en 2018 un calendario protagonizado
por doce de los afectados. En el mismo se visibilizan los
efectos que este fármaco y el paso del tiempo han causado
en sus cuerpos. Las fotografías de este trabajo han sido posibles
gracias a la colaboración desinteresada del fotógrafo Ángel
Álvarez, de reconocido prestigio en el mundo publicitario,
así como por su colaboración en otras iniciativas solidarias.

La tragedia de la talidomida cambió la visión
acerca de los riesgos asociados a la toma de medicamentos
de uso humano, no solo en Estados Unidos, sino en todo el
mundo. Se establecieron protocolos de actuación que priorizaron
la protección de la población frente a los conflictos de intereses
de médicos, políticos e industria farmacéutica. Una de las
consecuencias de la nueva política en materia de medicamentos
fue la retirada del mercado farmacéutico de un gran número
de fármacos de eficacia muy dudosa, nunca demostrada. En España
se produjeron muy pocos casos, la mayoría a partir de envases
de fármaco conseguidos allende las fronteras. La creación
de los sistemas de farmacovigilancia es una consecuencia de
la tragedia de la talidomida. El 31 de agosto de 2012 Harald
Stock , a la sazón jefe ejecutivo de Grünenthal, pidió oficialmente
disculpas a las víctimas y sus familias. La exculpación se
produjo en el acto de inauguración de una estatua de bronce
que representa a un niño sin miembros en la ciudad de Solberg
(Renania, Alemania), sede de la fábrica Chemie Grünenthal.
En su discurso se refirió al silencio que la compañía farmacéutica
mantuvo durante cincuenta años, pidiendo perdón por el dolo
causado involuntariamente. Harald Stock justificó a sus antecesores
afirmando que el laboratorio había realizado todos los estudios
clínicos posibles en base a los conocimientos disponibles
en la década de 1950. Algunos quisieron ver oportunismo al
hacer coincidir estas explicaciones con la celebración de
los Juegos Paralímpicos de Londres. La mayoría de las asociaciones
de afectados se han quejado siempre de las bajas compensaciones
recibidas. Cualquiera pensaría que la talidomida se convertiría
en un medicamento maldito , una ignominia de la farmacología.
Sin embargo, no ha sido así. La investigación, como tantas
veces sucede, supo sacar provecho de la desgracia. Los efectos
deletéreos sobre el desarrollo fetal podrían tener aplicación
clínica frenando el desarrollo tumoral. Se infirió que el
rápido crecimiento de los tejidos y órganos del feto podría
guardar alguna similitud con el crecimiento descontrolado
de los tejidos tumorales. Se llevaron a cabo algunos estudios
clínicos, con escasos resultados. Y la Talidomida cayó en
el olvido por segunda vez, las siguientes tres décadas.

Brasil aprobó doblar la pensión en 2018.
Durante los años de ostracismo de la talidomida
se produjeron algunas interesantes observaciones: en el año
1964, Jacob Sheskin, un médico israelí probó la talidomida
en un eritema nudoso en enfermos de lepra. La talidomida se
utilizó como último recurso para aliviar el prurito (picor)
extremo del paciente . La Talidomida resolvió el picor del
paciente a los tres días de tratamiento. Cuando se interrumpió
la administración de Talidomida el enfermo leproso volvió
a padecer un insoportable picor; y éste se solucionó reinstaurando
el tratamiento. Otras experiencias con similares resultados
fueron determinantes para que la Organización Mundial de la
Salud autorizase el empleo de la talidomida en el tratamiento
del eritema nodular en pacientes con lepra (enfermedad de
Hansen). La talidomida tiene acciones antiinflamatorias e
inmunosupresoras. Consiguientemente ha comenzado a usarse
en un creciente aunque limitado número de indicaciones, desde
el síndrome de Behçet, las úlceras bucales causadas por la
inmunosupresión en VIH positivos, sarcoma de Kaposi, enfermedad
de Crohn, y otras enfermedades infrecuentes. Para estas indicaciones,
la Talidomida se prescribe bajo criterio de «uso compasivo».
Con este fin, Estados Unidos lo importaba de fabricantes sudamericanos
de dudosa fiabilidad. Esta circunstancia determinó que la
Food and Drug Administration autorizase la comercialización
de la talidomida en 1998 para el tratamiento del eritema nudoso
de origen leproso. Aun cuando su indicación es muy específica,
los médicos la prescriben en otras enfermedades . No obstante
existe un programa (STEPS, de System for Thalidomide Education
and Prescribing Safety) que vigila que no pueda administrarse
la Talidomida mujeres encinta ni en edad de procrear. Todavía
más: la Talidomida ha servido de punto de partida para el
desarrollo de un importante medicamento anticanceroso, Lenalidomida.
He aquí un paradigma de cómo al cabo de los años, el fármaco
talidomida ha hallado la otredad de sí mismo.
--------------------------------------------------------------------------------------------------------------







--------------------------------------------------------------------------------------------------------------
|
