|
La Administración de Medicamentos y Alimentos
de Estados Unidos (FDA) ha aprobado, de manera urgente, el
primer fármaco contra el Alzheimer en casi dos décadas. Aduhelm
(aducanumab,) el medicamento del laboratorio Biogen, es el
primer tratamiento que se aprueba para esta patología neurodegenerativa
desde 2003, cuando se autorizó la memantina. La FDA reconoce
en un comunicado que la presentación del solicitante "dejaba
incertidumbres residuales con respecto al beneficio clínico",
pero concluye que "los beneficios superan a los riesgos" de
la terapia. La agencia estadounidense seguirá monitorizando
el fármaco tras su llegada al mercado y al paciente y exigirá
al laboratorio responsable que realice un ensayo clínico posterior
a esta aprobación para verificar su beneficio clínico. "Si
el medicamento no funciona según lo previsto, podemos tomar
medidas para retirarlo del mercado".
La aprobación de este fármaco se ha acelerado
porque, según explica la FDA, proporciona un "significativo
avance terapéutico" en comparación con otros tratamientos
al reducir las placas "beta amiloide" en el cerebro, que son
un signo de la enfermedad, y considera por tanto "razonable"
prever un beneficio importante para los afectados. De media,
un enfermo de Alzheimer vive entre cuatro y ocho años desde
el diagnóstico, aunque algunos llegan a los 20 años. En Estados
Unidos, seis millones de personas padecen la enfermedad, que
supone la sexta causa de muerte en el país. En el mundo hay
unos 50 millones de personas diagnosticadas con una demencia,
de las cuales entre el 60 % y el 70 % son Alzhéimer, según
datos de la Organización Mundial de la Salud (OMS). Las previsiones
estiman que los casos de deterioro cognitivo aumentarán a
82 millones en 2030 y 152 millones en 2050, debido al aumento
de la esperanza de vida, también en los países de ingresos
medios y bajos. Según la Sociedad Española de Neurología (SEN),
actualmente padecen esta enfermedad 800.000 personas en España
y entre el 30 y el 40% de los casos totales están sin diagnosticar
en nuestro país. Los pocos fármacos disponibles ni curan ni
frenan la progresión de la enfermedad. Es más, el 99,6 % de
los tratamientos que se investigan no se acaban aprobando,
según una revisión de casi medio millar de ensayos clínicos
llevados a cabo en una década.
--------------------------------------------------------------------------------------------------------------

--------------------------------------------------------------------------------------------------------------
El desarrollo es el proceso de llevar un nuevo
fármaco farmacéutico al mercado una vez que se ha identificado
un compuesto principal a través del proceso de descubrimiento.
Incluye investigación preclínica en microorganismos y animales,
solicitud de estatus regulatorio, como a través de la Administración
de Drogas y Alimentos de los Estados Unidos para un nuevo
medicamento en investigación para iniciar ensayos clínicos
en humanos, y puede incluir el paso de obtener la aprobación
regulatoria con una solicitud de medicamento para comercializar
la droga.
Las nuevas entidades químicas (NCE o New chemical
entities, también conocidas como nuevas entidades moleculares
o NME) son compuestos que surgen del proceso de descubrimiento
de fármacos. Estos tienen una actividad prometedora contra
un objetivo biológico particular que es importante en la enfermedad.
Sin embargo, se sabe poco sobre la seguridad, toxicidad, farmacocinética
y metabolismo de esta NCE en humanos. La función del desarrollo
de fármacos es evaluar todos estos parámetros antes de los
ensayos clínicos en humanos. Otro objetivo importante del
desarrollo de fármacos es recomendar la dosis y el horario
para el primer uso en un ensayo clínico en humanos ("first-in-human"
[FIH] o First Human Dose [FHD], anteriormente también conocida
como "first-in-man" [FIM]). Además, el desarrollo de fármacos
debe establecer las propiedades fisicoquímicas del NCE: su
composición química, estabilidad y solubilidad. Los fabricantes
deben optimizar el proceso que utilizan para fabricar el producto
químico, de modo que puedan escalar desde un químico medicinal
que produce miligramos hasta la fabricación en la escala de
kilogramos y toneladas.

Además, examinan la idoneidad del producto para
envasar como cápsulas, tabletas, aerosoles, inyectables intramusculares,
inyectables subcutáneos o formulaciones intravenosas. Juntos,
estos procesos se conocen en el desarrollo clínico y preclínico
como química, fabricación y control (CMC). Muchos aspectos
del desarrollo de medicamentos se centran en satisfacer los
requisitos reglamentarios de las autoridades que otorgan licencias
de medicamentos. Por lo general, estos constituyen una serie
de pruebas diseñadas para determinar las principales toxicidades
de un compuesto nuevo antes del primer uso en humanos. Es
un requisito legal que se realice una evaluación de la toxicidad
de los órganos principales (efectos en el corazón y pulmones,
cerebro, riñón, hígado y sistema digestivo), así como los
efectos en otras partes del cuerpo que podrían verse afectadas
por el fármaco (por ejemplo, la piel si el nuevo fármaco debe
administrarse a través de la piel). Cada vez más, estas pruebas
se realizan utilizando métodos in vitro (por ejemplo, con
células aisladas), pero muchas pruebas solo se pueden realizar
utilizando animales de experimentación para demostrar la compleja
interacción del metabolismo y la exposición al fármaco en
la toxicidad. La información se recopila a partir de estas
pruebas preclínicas, así como la información sobre CMC, y
se envía a las autoridades reguladoras (en los EE. UU., a
la FDA), como una solicitud de Nuevo Medicamento en Investigación
(IND). Si se aprueba el IND, el desarrollo pasa a la fase
clínica.
Ya en esta fase, los ensayos clínicos implican
cuatro pasos:
Los ensayos de fase I, generalmente en voluntarios
sanos, determinan la seguridad y la dosificación.
Los ensayos de fase II se utilizan para obtener
una lectura inicial de la eficacia y explorar más a fondo
la seguridad en un pequeño número de pacientes que padecen
la enfermedad a la que se dirige la NCE.
Los ensayos de fase III son ensayos grandes
y fundamentales para determinar la seguridad y la eficacia
en un número suficientemente grande de pacientes con la enfermedad
objetivo. Si la seguridad y la eficacia se prueban adecuadamente,
las pruebas clínicas pueden detenerse en este paso y la NCE
avanza a la etapa de solicitud de nuevo fármaco (NDA).
Los ensayos de fase IV son ensayos posteriores
a la aprobación que a veces son una condición adjunta por
la FDA, también llamados estudios de vigilancia posteriores
a la comercialización.

El proceso de definir las características del
medicamento no se detiene una vez que una NCE comienza los
ensayos clínicos en humanos. Además de las pruebas necesarias
para trasladar un fármaco nuevo a la clínica por primera vez,
los fabricantes deben asegurarse de que las toxicidades crónicas
o a largo plazo estén bien definidas, incluidos los efectos
en sistemas no controlados previamente (fertilidad, reproducción,
sistema inmunológico, entre otros). También deben probar el
compuesto por su potencial de causar cáncer (prueba de carcinogenicidad).
Si un compuesto surge de estas pruebas con una toxicidad aceptable
y un perfil de seguridad, y la empresa puede demostrar además
que tiene el efecto deseado en los ensayos clínicos, entonces
la cartera de pruebas de NCE puede enviarse para su aprobación
comercial en los diversos países donde el fabricante planea
para venderlo.
En los Estados Unidos, este proceso se denomina
"solicitud de nuevo medicamento" o NDA. La mayoría de las
NCE fracasan durante el desarrollo de fármacos, ya sea porque
tienen una toxicidad inaceptable o simplemente porque no tienen
el efecto deseado sobre la enfermedad objetivo, como se muestra
en los ensayos clínicos. Una tendencia hacia la recopilación
de información genética y de biomarcadores de los participantes
de los ensayos clínicos, y el aumento de la inversión de las
empresas en esta área, llevó en 2018 a la mitad de todos los
ensayos de medicamentos que recopilaron esta información,
y la prevalencia alcanzó más del 80% entre los ensayos de
oncología.
Un estudio de 2010 evaluó los costos tanto capitalizados
como de bolsillo para llevar un solo medicamento nuevo al
mercado en aproximadamente US $ 1.800 millones y $ 870 millones,
respectivamente. Una estimación del costo medio de los ensayos
de 2015-16 para el desarrollo de 10 medicamentos contra el
cáncer fue de 648 millones de dólares. En 2017, el costo medio
de un ensayo fundamental en todas las indicaciones clínicas
fue de 19 millones de dólares. El costo promedio de un ensayo
fundamental para demostrar su equivalencia o superioridad
a un medicamento aprobado existente fue de $ 347 millones.
El costo total de llevar un nuevo medicamento (es decir, una
nueva entidad química) al mercado, desde el descubrimiento
a través de los ensayos clínicos hasta la aprobación, es complejo
y controvertido. Normalmente, las empresas gastan decenas
a cientos de millones de dólares estadounidenses. Un elemento
de la complejidad es que las cifras finales muy publicitadas
a menudo no solo incluyen los gastos de bolsillo para realizar
una serie de ensayos clínicos de Fase I-III, sino también
los costos de capital del período largo (10 años o más) durante
el cual la empresa debe cubrir los gastos de bolsillo para
el descubrimiento de fármacos preclínicos. En un análisis
de los costos de desarrollo de medicamentos para 98 compañías
durante una década, el costo promedio por medicamento desarrollado
y aprobado por una sola compañía farmacéutica fue de 350 millones
de dólares. Pero para las empresas que aprobaron entre ocho
y 13 medicamentos durante 10 años, el costo por medicamento
llegó a $ 5.5 mil millones, debido principalmente a la expansión
geográfica para la comercialización y los costos continuos
de los ensayos de fase IV y el monitoreo continuo de la seguridad.
Las alternativas al desarrollo de fármacos convencionales
tienen como objetivo que las universidades, los gobiernos
y la industria farmacéutica colaboren y optimicen los recursos.
La naturaleza de un proyecto de desarrollo de
medicamentos se caracteriza por altas tasas de deserción,
grandes gastos de capital y plazos prolongados. Esto hace
que la valoración de tales proyectos y empresas sea una tarea
desafiante. No todos los métodos de valoración pueden hacer
frente a estas particularidades. Los métodos de valoración
más utilizados son el valor actual neto ajustado al riesgo
(rNPV), los árboles de decisión, las opciones reales o los
comparables. Los impulsores de valor más importantes son el
costo de capital o la tasa de descuento que se utiliza, los
atributos de fase como la duración, las tasas de éxito y los
costos, y las ventas previstas, incluido el costo de bienes
y los gastos de marketing y ventas. Aspectos menos objetivos
como la calidad de la gestión o la novedad de la tecnología
deben reflejarse en la estimación de los flujos de efectivo.
Los candidatos a un nuevo fármaco para tratar
una enfermedad podrían, teóricamente, incluir de 5.000 a 10.000
compuestos químicos. En promedio, alrededor de 250 de estos
son lo suficientemente prometedores para una evaluación adicional
utilizando pruebas de laboratorio, ratones y otros animales
de prueba. Por lo general, alrededor de diez de estos califican
para pruebas en humanos. Un estudio realizado por el Centro
Tufts para el Estudio del Desarrollo de Fármacos que cubrió
las décadas de 1980 y 1990 encontró que solo el 21.5 por ciento
de los medicamentos que comenzaron los ensayos de Fase I finalmente
fueron aprobados para su comercialización. En el período de
2006 a 2015, la tasa de éxito fue del 9,6%. Las altas tasas
de fracaso asociadas con el desarrollo farmacéutico se conocen
como el problema de la "tasa de deserción". La toma de decisiones
cuidadosa durante el desarrollo de medicamentos es esencial
para evitar costosos fracasos. En muchos casos, el diseño
inteligente de programas y ensayos clínicos puede evitar resultados
negativos falsos. Los estudios de búsqueda de dosis bien diseñados
y las comparaciones con un grupo de tratamiento con placebo
y con el estándar de oro desempeñan un papel importante en
la obtención de datos fiables.
|
La Agencia Española de Medicamentos y Productos Sanitarios,
llamada anteriormente AGEMED, es una agencia estatal
de España creada por la Ley 66/1997, de 30 de diciembre,
con rango de organismo autónomo hasta 2011 y a partir
de entonces como agencia estatal. Sus competencias fueron
ampliadas por la Ley 50/1998.

María Jesús Lamas Díaz es una farmacéutica e investigadora
española. Desde el 20 de julio de 2018, es directora
de la Agencia Española de Medicamentos.

|
Las iniciativas novedosas incluyen la asociación
entre organizaciones gubernamentales y la industria, como
la Iniciativa Europea de Medicamentos Innovadores. La Administración
de Alimentos y Medicamentos de EE. UU. creó la "Iniciativa
de ruta crítica" para mejorar la innovación en el desarrollo
de medicamentos, y la designación de Terapia Innovadora para
acelerar el desarrollo y la revisión regulatoria de medicamentos
candidatos para los cuales la evidencia clínica preliminar
muestra que el medicamento candidato puede mejorar sustancialmente
la terapia por un trastorno grave. En marzo de 2020, el Departamento
de Energía de los Estados Unidos, la Fundación Nacional de
Ciencias, la NASA, la industria y nueve universidades reunieron
recursos para acceder a supercomputadoras de IBM, combinados
con recursos de computación en la nube de Hewlett Packard
Enterprise, Amazon, Microsoft y Google, para el descubrimiento
de fármacos.
El Consorcio de Computación de Alto Rendimiento
COVID-19 también tiene como objetivo pronosticar la propagación
de enfermedades, modelar posibles vacunas y analizar miles
de compuestos químicos para diseñar una vacuna o terapia contra
el COVID-19. En mayo de 2020, se lanzó la asociación OpenPandemics
- COVID-19 entre Scripps Research y World Community Grid de
IBM. La asociación es un proyecto de computación distribuida
que "ejecutará automáticamente un experimento simulado en
segundo plano [de PC domésticos conectados] que ayudará a
predecir la efectividad de un compuesto químico en particular
como posible tratamiento para la COVID-19".
--------------------------------------------------------------------------------------------------------------

--------------------------------------------------------------------------------------------------------------
La enfermedad de Alzheimer (EA), denominada
demencia senil de tipo Alzheimer (DSTA) o simplemente alzhéimer,
es una enfermedad neurodegenerativa, producto de un proceso
de neurodegeneración, y que se manifiesta como deterioro cognitivo
y trastornos conductuales. Se caracteriza en su forma típica
por una pérdida de la memoria inmediata y de otras capacidades
mentales (tales como las capacidades cognitivas superiores),
a medida que mueren las células nerviosas (neuronas) y se
atrofian diferentes zonas del cerebro. La enfermedad suele
tener una duración media aproximada —después del diagnóstico—
de 10 años, aunque esto puede variar en proporción directa
con la severidad de la enfermedad al momento del diagnóstico.
La enfermedad de Alzheimer es la forma más común de demencia,
es incurable y terminal, y aparece con mayor frecuencia en
personas mayores de 65 años de edad, aunque también en raros
casos puede desarrollarse a partir de los 40 años. Muchas
personas experimentan olvidos o retrasos leves de memoria,
que son parte del proceso normal de envejecimiento. La mayoría
de las personas tienen dificultades ocasionales para recordar
una palabra o el nombre de alguien. Sin embargo, una persona
con la enfermedad de Alzheimer u otros tipos de demencia,
encontrará estos síntomas cada vez más frecuentes y graves.
|
Los signos que indican la enfermedad de Alzheimer pueden
incluir:
- Cambios en la personalidad.
- Deterioro en la capacidad de movimiento o al caminar.
- Dificultad para comunicarse.
- Bajo nivel de energía.
- Pérdida de memoria.
- Cambios de estado de ánimo.
- Problemas de atención y orientación.
- Incapacidad de resolver operaciones aritméticas sencillas.

Ciertas actividades intelectuales, tales como el jugar
ajedrez, así como las interacciones sociales regulares,
han sido asociadas en estudios epidemiológicos con un
reducido riesgo de contraer la enfermedad de Alzheimer.
Sin embargo, no se ha encontrado aún una relación causal.
|
Los síntomas como una entidad nosológica definida
fueron identificados por el psiquiatra alemán Emil Kraepelin,
mientras que la neuropatología característica fue observada
por primera vez por el psiquiatra y neurólogo alemán Alois
Alzheimer en 1906. Así pues, el descubrimiento de la enfermedad
fue obra de ambos psiquiatras, que trabajaban en el mismo
laboratorio. Sin embargo, dada la gran importancia que Kraepelin
daba a encontrar la base neuropatológica de los desórdenes
psiquiátricos, decidió nombrar a la enfermedad Alzheimer en
honor a su compañero. Por lo general, el síntoma inicial es
la inhabilidad de adquirir nuevos recuerdos, pero suele confundirse
con actitudes relacionadas con la vejez o el estrés. Ante
la sospecha de alzhéimer, el diagnóstico se realiza con evaluaciones
de conductas cognitivas, así como neuroimágenes, si están
disponibles. A medida que progresa la enfermedad, aparecen
confusión mental, irritabilidad y agresión, cambios del humor,
trastornos del lenguaje, pérdida de la memoria de corto plazo
y una predisposición a aislarse a medida que declinan los
sentidos del paciente.
Gradualmente se pierden las funciones biológicas,
que finalmente conllevan a la muerte. El pronóstico para cada
individuo es difícil de determinar. El promedio general es
de siete años, menos del 3% de los pacientes viven más de
14 años después del diagnóstico. La causa de la enfermedad
de Alzheimer permanece desconocida, aunque las últimas investigaciones
parecen indicar que están implicados procesos de tipo priónico.
Las investigaciones suelen asociar la enfermedad a la aparición
de placas seniles y ovillos neurofibrilares. Los tratamientos
actuales ofrecen moderados beneficios sintomáticos, pero no
hay tratamiento que retrase o detenga el progreso de la enfermedad.
No obstante, casos preliminares de asociación
de demencia por Alzheimer con la enfermedad celíaca mostraron
la mejoría con el seguimiento de una dieta sin gluten. En
la actualidad, el diagnóstico exacto solo se consigue post-mortem,
por lo que existe un gran interés en encontrar marcadores
genéticos que permitan una detección temprana de esta enfermedad
que sería más fácil de tratar que en los estadios más avanzados.
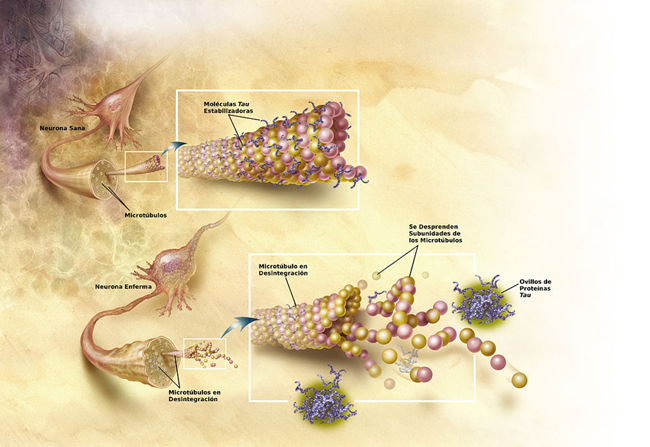
En la enfermedad de Alzheimer, los cambios en
la proteína tau producen la desintegración de los microtúbulos
en las células cerebrales.
Para la prevención del alzhéimer, se han sugerido
varios hábitos conductuales, pero no hay evidencias publicadas
que destaquen los beneficios de esas recomendaciones, incluyendo
la estimulación mental y la dieta equilibrada. El papel que
juega el cuidador del sujeto con alzhéimer es fundamental,
aun cuando las presiones y la demanda física de esos cuidados
pueden llegar a ser una gran carga personal. El Día Internacional
del Alzheimer se conmemora el 21 de septiembre, fecha elegida
por la OMS y la Federación Internacional de Alzheimer, en
la cual se llevan a cabo actividades en diversos países para
concienciar y ayudar a prevenir la enfermedad. La Organización
Mundial de la Salud (OMS) realizó en 2015 su Primera Conferencia
Ministerial de la OMS sobre la Acción Mundial contra la Demencia.
--------------------------------------------------------------------------------------------------------------


--------------------------------------------------------------------------------------------------------------

--------------------------------------------------------------------------------------------------------------

--------------------------------------------------------------------------------------------------------------
|
