|
El desarrollo de las herramientas basadas en
CRISPR para editar el genoma les sirvió a las investigadoras
Jennifer Doudna y Emmanuelle Charpentier para ganar el Premio
Nobel de Química en 2020. Menos de un año después, se acaban
de dar a conocer los primeros datos de un ensayo clínico que
está usando esa misma tecnología para tratar una enfermedad
rara y mortal inactivando el gen responsable. Con un añadido
decisivo: por primera vez se ha usado inyectando la herramienta
directamente en la sangre de los pacientes, lo que hace que
pueda viajar por todo su cuerpo.
Los resultados son iniciales pero prometedores.
Se presentaron conjuntamente en la revista New England Journal
of Medicine y en la reunión internacional de la Sociedad de
Nervio Periférico. Según Luis Querol, neurólogo en el Hospital
Sant Pau de Barcelona y codirector del programa científico
de la reunión, “fue la presentación estrella del congreso.
Causó muchísima expectación, pero también cautela”.
La enfermedad en cuestión recibe el nombre de
amiloidosis por transtiretina. Se produce por la acumulación
de una proteína mal plegada que se va acumulando en diferentes
lugares, como los nervios y el corazón. Y aunque su evolución
es variable, la mayor parte de los pacientes muere entre 2
y 17 años después de recibir el diagnóstico. Desde hace unos
pocos años, sin embargo, existen tratamientos eficaces. “Su
aparición fue un hito”, describe Querol, “pero también tienen
inconvenientes. Algunos tienen efectos secundarios. Y en ciertos
casos implican tener que administrarlos en el hospital de
por vida cada tres semanas, preparando a los pacientes con
corticoides cada una de esas veces”. Un tratamiento eficaz
de edición genética implicaría actuar una sola vez para toda
la vida.

Investigadora de Intellia, la compañía de la
Nobel Jennifer Doudna que lleva a cabo el ensayo.
“Hasta ahora, los ensayos clínicos con CRISPR
se han hecho modificando células en el laboratorio para corregir
ciertas formas de anemia y para tratar algunos tipos de cáncer
mediante inmunoterapia”, explica Lluís Montoliu, investigador
del Centro Nacional de Biotecnología del CSIC, presidente
del Comité de Ética de esa misma institución y uno de los
referentes sobre esta técnica en España. “También se ha probado
para tratar un tipo de ceguera, la amaurosis congénita de
Leber. Pero el ojo es un órgano muy especial que está muy
aislado del resto del cuerpo. Inyectar la herramienta directamente
en la sangre es otro cantar”.
La enfermedad escogida es un gran modelo de
prueba. Por muchas razones, es una piedra de toque ideal y
seguramente por eso la escogieron los investigadores. Para
empezar, depende de un solo gen. Además, la proteína que la
causa no es esencial para la vida y solo afecta al metabolismo
de la vitamina A y de la tiroides. “En principio, con dar
suplementos de la vitamina y vigilar la función tiroidea es
suficiente”, explica Querol. “Eso es lo que hacemos con los
tratamientos actuales”. Y hay una ventaja añadida: el 99%
de la proteína se produce en el hígado. Si se consigue dirigir
la herramienta allí, se aumenta la eficacia limitando los
posibles efectos secundarios. Eso es lo que han hecho.
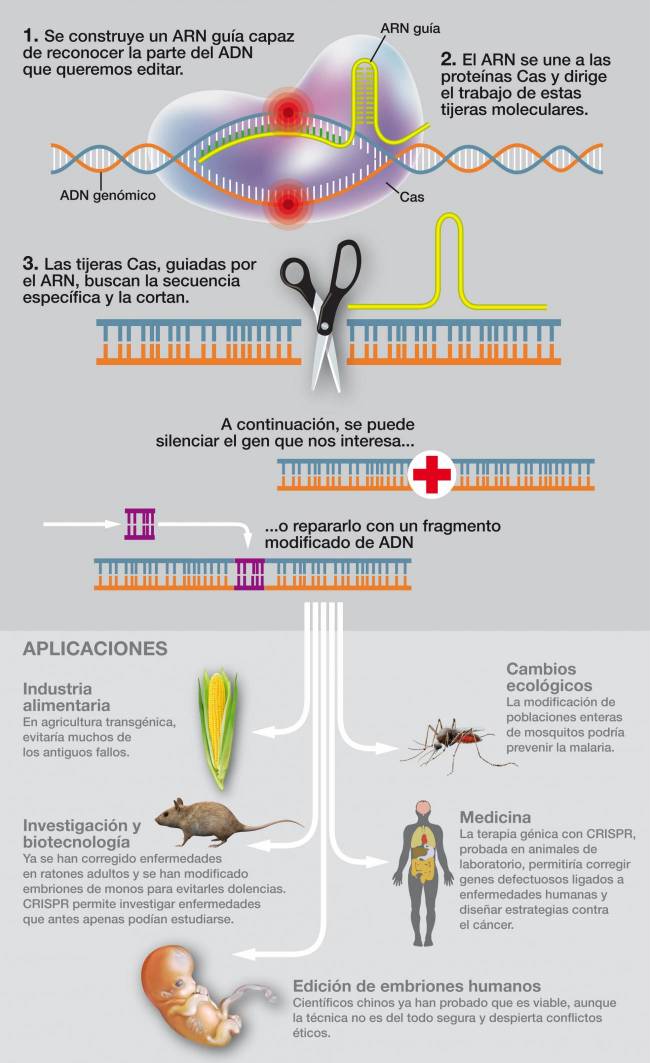
La herramienta de edición se compone básicamente
de dos elementos: un fragmento de ARN que sirve de guía hacia
el gen objetivo y una proteína —llamada cas9— que actúa de
tijera y que lo corta, inactivándolo. Los investigadores han
reunido varias técnicas en su ensayo. Por un lado han codificado
la proteína también en forma de ARN, como algunas de las vacunas
contra la covid. Por otro, han rodeado la herramienta de una
envoltura especial diseñada para ser recogida por ciertas
proteínas de la sangre que, en su inmensa mayoría, terminan
en el hígado. Los resultados parecen prometedores. “Ya lo
habían probado con ratones y con primates no humanos, que
es como debe hacerse”, explica Montoliu. “Ahora detallan bien
esto último, confirmando que lo conseguido parece durar a
largo plazo. Y dan los primeros datos en humanos”.
|
El ácido ribonucleico es un ácido nucleico formado
por una cadena de ribonucleótidos. Está presente tanto
en las células procariotas como en las eucariotas, y
es el único material genético de ciertos virus. Se pusieron
muchas esperanzas en esta molécula en la lucha
contra la actual pandemia.
|
Son solo seis pacientes de entre 46 y 64 años
que se han repartido para recibir dos dosis diferentes, ambas
todavía bajas. Sin embargo, a la dosis más elevada, la cantidad
de proteína disminuía de media un 87 %. “Esa reducción es
igual o incluso mayor que con los tratamientos actuales”,
confirma Querol. “Y seguramente más estable”. Los efectos
secundarios parecen escasos y leves. Sin embargo, todavía
existen reservas y aspectos a confirmar. “De momento solo
han pasado 28 días desde el tratamiento”, explica Querol.
“Necesitaremos al menos tres meses y seguramente seis para
saber si clínicamente es eficaz y se ve una mejoría. En el
congreso se recibió como un hito tecnológico, pero médicamente
ya había tratamientos eficaces. Y se plantearon preguntas
sobre la seguridad”. Uno de los problemas que puede dar el
uso de CRISPR son los efectos llamados off-target. Estas son
mutaciones no deseadas consecuencia de que podrían producirse
cortes en otras zonas del ADN. También podrían darse fallos
de corrección en la región deseada tras el corte. Según Montoliu,
“los estudios de seguridad que han hecho previamente son los
apropiados. Las tasas de error no parecen mayores que las
que ocurren normalmente en nuestras células de forma cotidiana”.
Los investigadores consideran que el riesgo es bajo, pero
reconocen que los voluntarios van a pasar revisiones periódicas
durante mucho tiempo.
Otra cuestión que saltó en el congreso fue la
posibilidad de que se alteraran los gametos, las células sexuales.
Aunque hay formas hereditarias de la enfermedad, muchas no
lo son. Si se inactivara el gen en ellas, la alteración artificial
podría pasar a los descendientes. Y aunque el diseño está
hecho para que la mayor parte del tratamiento haga su papel
en el hígado, no se ha estudiado cuánto puede escapar de él.
“Creo que la probabilidad de que suceda es baja”, afirma Montoliu,
“pero desde luego no es imposible. Eso es algo que habrá que
estudiar en modelos animales”.
La promotora del ensayo es la compañía Intellia,
que se ha asociado con la farmacéutica Regeneron. Jennifer
Doudna es cofundadora de la primera, cuyas acciones en los
días posteriores al anuncio y la publicación subieron cerca
de un 70 %. Tradicionalmente cauta, sus declaraciones a la
revista Science son particularmente entusiastas: “Este es
un primer paso fundamental para poder inactivar, reparar o
reemplazar cualquier gen que cause una enfermedad, en cualquier
parte del cuerpo". Para Montoliu, ese mensaje “no está justificado
con los datos actuales”. Actuar sobre otros lugares del cuerpo
puede implicar diseños específicos que todavía no se han probado.
Además, “hasta ahora lo que hemos aprovechado de CRISPR es
su capacidad para inactivar genes, que es justo para lo que
evolucionó la herramienta en las bacterias y en las arqueas,
para defenderse de los virus que las amenazan cortando su
ADN. Corregir los genes es más complicado y es algo que todavía
no tenemos controlado”.
“Los resultados de este ensayo son desde luego
prometedores, pero tampoco aquí hay que echar aún las campanas
al vuelo”, añade. “Necesitamos ver su efecto en más pacientes
y necesitamos seguir a estos pacientes durante más tiempo.
Y eso es lo que se va a hacer”.
--------------------------------------------------------------------------------------------------------------


--------------------------------------------------------------------------------------------------------------
El ARN, o ácido ribonucleico, es un ácido nucleico
similar en estructura al ADN pero con algunas diferencias
sutiles. La célula utiliza el ARN para una serie de tareas
diferentes; una de estas moléculas se llama ARN mensajero
o ARNm. Y es la molécula de ácido nucleico cuya traducción
transfiere información del genoma a las proteínas. Otra forma
de ARN es el ARNt o ARN de transferencia, y moléculas de ARN
no-codificantes de proteínas que físicamente llevan los aminoácidos
al sitio dónde se lleva a cabo la traducción y permiten que
sean ensamblados en las cadenas de proteínas en dicho proceso.
Formado por una cadena de ribonucleótidos, está
presente tanto en las células procariotas como en las eucariotas,
y es el único material genético de ciertos virus (los virus
ARN). El ARN se puede definir como la molécula formada por
una cadena simple de ribonucleótidos, cada uno de ellos formado
por ribosa, un fosfato y una de las cuatro bases nitrogenadas
(adenina, guanina, citosina y uracilo). El ARN celular es
lineal y monocatenario (de una sola cadena), pero en el genoma
de algunos virus es de doble hebra. En los organismos celulares
desempeña diversas funciones. Es la molécula que dirige las
etapas intermedias de la síntesis proteica; el ADN no puede
actuar solo, y se vale del ARN para transferir esta información
vital durante la síntesis de proteínas (producción de las
proteínas que necesita la célula para sus actividades y su
desarrollo). Varios tipos de ARN regulan la expresión génica,
mientras que otros tienen actividad catalítica. El ARN es,
pues, mucho más versátil que el ADN.
|

Johan Friedrich Miescher (Basilea, 13 de agosto de
1844 - Davos, 26 de agosto de 1895) fue un biólogo y
médico suizo. Aisló varias moléculas ricas en fosfatos,
a las cuales llamó nucleínas (actualmente ácidos nucleicos),
a partir del núcleo de los glóbulos blancos en 1869,
y así preparó el camino para su identificación como
los portadores de la información hereditaria, el ADN.
Este descubrimiento, que se publicó por primera vez
en 1871, al principio no pareció relevante, hasta que
Albrecht Kossel hizo sus primeras investigaciones en
su estructura química. El trabajo se realizó en el laboratorio
de Felix Hoppe-Seyler, en el palacio de Tubinga. También
demostró que la regulación de la respiración depende
de la concentración de dióxido de carbono en la sangre.
En 1872 se convirtió en profesor de la Universidad de
Basilea. Sufrió de tuberculosis durante la década de
1890 y falleció a los 51 años, en Davos, el 23 de agosto
de 1895. El Laboratorio Friedrich Miescher de la Sociedad
Max Planck lleva su nombre.
|
Los ácidos nucleicos fueron descubiertos en
1867 por Friedrich Miescher, que los llamó nucleína, ya que
los aisló del núcleo celular. Más tarde, se comprobó que las
células procariotas, que carecen de núcleo, también contenían
ácidos nucleicos. El papel del ARN en la síntesis de proteínas
fue sospechado en 1939. Severo Ochoa ganó el Premio Nobel
de Medicina en 1959 tras descubrir cómo se sintetizaba el
ARN. En 1965 Robert W. Holley halló la secuencia de 77 nucleótidos
de un ARN de transferencia de una levadura, con lo que obtuvo
el Premio Nobel de Medicina en 1968. En 1967, Carl Woese comprobó
las propiedades catalíticas de algunos ARN y sugirió que las
primeras formas de vida usaron ARN como portador de la información
genética tanto como catalizador de sus reacciones metabólicas
(hipótesis del mundo de ARN). En 1976, Walter Fiers y sus
colaboradores determinaron la secuencia completa del ARN del
genoma de un virus ARN (bacteriófago MS2). En 1990 se descubrió
en Petunia que genes introducidos pueden silenciar genes similares
de la misma planta, lo que condujo al descubrimiento del ARN
interferente. Aproximadamente al mismo tiempo se hallaron
los micro ARN, pequeñas moléculas de 22 nucleótidos que tenían
algún papel en el desarrollo de Caenorhabditis elegans. El
descubrimiento de ARN que regulan la expresión génica ha permitido
el desarrollo de medicamentos hechos de ARN, como los ARN
pequeños de interferencia que silencian genes. En el año 2016
se tiene prácticamente por comprobado que las moléculas de
ARN fueron la primera forma de vida propiamente dicha en habitar
el planeta Tierra (Hipótesis del mundo de ARN).
Pásate por los destacados en Diciembre
de 2025.
--------------------------------------------------------------------------------------------------------------

--------------------------------------------------------------------------------------------------------------

--------------------------------------------------------------------------------------------------------------
|
