|
Dmitri Ivánovich Mendeléyev fue un químico ruso, conocido
por haber descubierto el patrón subyacente en lo que ahora
se conoce como la tabla periódica de los elementos. Sobre
las bases del análisis espectral establecido por los alemanes
Robert Bunsen y Gustav Kirchhoff, se ocupó de problemas químico-físicos
relacionados con el espectro de emisión de los elementos.
Realizó las determinaciones de volúmenes específicos y analizó
las condiciones de licuefacción de los gases, así como también
el origen de los petróleos. Su investigación principal fue
la que dio origen a la enunciación de la ley periódica de
los elementos, base del sistema periódico que lleva su nombre.
Le influyó el artículo de 1858 "Sunto di un corso di
Filosofia Chimica" de Stanislao Cannizzaro. En 1869 publicó
su libro Principios de la química, en el que desarrollaba
la teoría de la tabla periódica.
Dmitri Ivánovich Mendeléyev era el menor de al menos 17 hermanos
de la familia formada por Iván Pávlovich Mendeléyev y María
Dmítrievna Mendeléyeva. En el mismo año en que nació, su padre
quedó ciego perdiendo así su trabajo, era el director del
colegio del pueblo. Uno de los mayores rasgos físicos era
su enorme barba la cual según dicen los historiadores solo
se afeitaba una vez al año. Recibían una pensión insuficiente,
por lo que la madre tuvo que tomar las riendas de la familia
y dirigir la fábrica de cristal que había fundado su abuelo.
Desde joven destacó en ciencias en la escuela, no así en ortografía.
Un cuñado suyo, exiliado por motivos políticos, y un químico
de la fábrica le inculcaron el amor por las ciencias. La familia
sufrió, ya que Dmitri solo terminó el bachillerato, su padre
murió y la fábrica de cristal que su madre dirigía, se quemó.

Stanislao Cannizzaro, químico italiano
conocido por sus investigaciones en la reforma atómica.
Esta apostó por invertir los ahorros en la educación de Dmitri,
en vez de reconstruir la fábrica. En esa época la mayoría
de los hermanos, excepto una hermana, ya se habían independizado,
y la madre se los llevó a Moscú para que Dmitri pudiese ingresar
a la Universidad. Sin embargo, Mendeléyev, no fue admitido;
su origen siberiano le cerró las puertas de las universidades
de Moscú y San Petersburgo, por lo que se formó en el Instituto
Pedagógico de esta última ciudad. En 1862 se casó, obligado
por su hermana, con Feozva Nikítichna Leschiova con la que
tuvo tres hijos, uno de los cuales falleció. Este fue un matrimonio
infeliz y desde 1871 vivieron separados. Fue acusado de bígamo,
pues una vez divorciado de su esposa volvió a contraer matrimonio
con ella, sin esperar los siete años que exigía la legislación
rusa, aunque tuvo la suerte de que la pena recayó sobre el
párroco que los había casado.
Encontró la felicidad casándose con Anna Ivánovna Popova,
26 años menor que él. Para lograrlo, Mendeléyev estuvo cuatro
años desesperado, incluso llegó a caer en una depresión, debido
a que su mujer se negaba a concederle el divorcio y la familia
de Anna se oponía tajantemente. A punto de darse por vencido,
consiguió el divorcio de su esposa y fue en busca de Anna
que se encontraba en Roma. En 1882 contrajeron matrimonio.
Tuvieron cuatro hijos, la mayor de los cuales, Liubov, se
casaría con el poeta ruso Aleksandr Blok. Aunque es más conocido
en Occidente por haber creado la Tabla periódica de los elementos,
la contribución de Dmitri Mendeléyev al desarrollo de Rusia
fue muy vasta y por ello es reconocido como una verdadera
personalidad del Renacimiento ruso. Sus campos de estudio
variaron desde la química hasta la aeronáutica. Su amplio
conocimiento lo llevó a convertirse en una figura influyente
entre sus contemporáneos, fue asesor del ministro de Hacienda
de Rusia, Serguéi Witte, y escribió más de 70 artículos sobre
el desarrollo económico y social del país. Mendeléyev fue
uno de los más grandes maestros de su tiempo y se le atribuye
el mérito de haber educado a miles de estudiantes. Falleció
el 2 de febrero de 1907, casi ciego. Se considera a Mendeléyev
un genio, no sólo por el ingenio que mostró para aplicar todo
lo conocido y predecir lo no conocido sobre los elementos
químicos y plasmarlo en la tabla periódica, sino por los numerosos
trabajos realizados a lo largo de toda su vida en diversos
campos de la ciencia, agricultura, ganadería, industria y
petróleo.
Presentó la tesis Sobre volúmenes específicos para conseguir
la plaza de maestro de escuela, y la tesis Sobre la estructura
de las combinaciones silíceas para alcanzar la plaza de cátedra
de química en la Universidad de San Petersburgo. A los 23
años era ya encargado de un curso de dicha universidad. Gracias
a una beca, pudo ir a Heidelberg, donde realizó diferentes
investigaciones junto a Gustav Kirchhoff y Robert Bunsen,
y publicó un artículo sobre "La cohesión de algunos líquidos
y sobre el papel de la cohesión molecular en las reacciones
químicas de los cuerpos”. Este trabajo lo pudo realizar gracias
a unos aparatos de precisión encargados en París con los cuales
encontró la temperatura absoluta de ebullición, y descubrió
por qué algunos gases no se podían licuar (porque se encontraban
por encima de la temperatura de ebullición).
Participó en el congreso de Karlsruhe donde quedó impresionado
por las ideas sobre el peso de los elementos que planteó Cannizzaro.
Al volver a San Petersburgo se encontró sin trabajo fijo,
lo que le dio tiempo para escribir diferentes obras. Entre
las cuales destaca su libro Química orgánica, que escribió
influido por lo que había escuchado en Karlsruhe.

Facultad de Química de la Universidad
de Murcia.
Sobre la personalidad de Mendeléyev se puede decir que era
un adicto al trabajo y su fama de mal carácter estaba basada
en que mientras trabajaba, gritaba, gruñía y refunfuñaba.
Se dice que alguien le preguntó sobre su mal genio, a lo que
contestó que era una manera de mantenerse sano y no contraer
una úlcera. En 1864 fue nombrado profesor de tecnología y
química del Instituto Técnico de San Petersburgo. En 1867,
ocupó la cátedra de química en la Universidad de San Petersburgo,
donde estudió el isomorfismo, la compresión de los gases y
las propiedades del aire enrarecido. Permanecería en esta
cátedra 23 años. Mendeléyev estaba a favor de la introducción
de reformas en el sistema educativo ruso. No consiguió ser
elegido presidente de la academia imperial de ciencias, debido
a su liberalismo. En 1890, terminó su estancia en la universidad,
debido a que intercedió por los estudiantes, y entregó a Iván
Deliánov, ministro de Instrucción Pública, una carta dirigida
al zar Alejandro III de Rusia. El ministro se la devolvió
con una nota adjunta que decía:
Por orden del ministro de Instrucción Pública, el papel
que se adjunta se devuelve al Consejero de Estado, profesor
Mendeléyev, ya que ni el ministro ni ninguno de los que están
al servicio de su Majestad Imperial tiene derecho de recibir
esta clase de papeles…
Indignado, Dmitri dejó las aulas de la universidad. Quizá
por esto, se mantuvo desde entonces al margen de la política
y del Estado, aunque manifestaba sus ideas liberales y su
oposición a la opresión. En 1865, tras la liberación de los
siervos producida en 1861, decidió comprar una granja en la
que puso en práctica métodos científicos para la mejora de
la cosecha y tuvo una relación humanitaria con los campesinos.
Obtuvo un rendimiento muy por encima de lo que se producía
antes, por lo que muchos campesinos de granjas cercanas fueron
a pedir su consejo.
|
La Reforma Emancipadora de 1861 en Rusia fue la primera
y más importante de las reformas liberales llevadas
a cabo durante el gobierno del zar Alejandro II de Rusia.
La reforma significó la liquidación de la dependencia
servil anteriormente sufrida por los campesinos rusos.
La base legal de la reforma fue el Manifiesto de Emancipación
del zar del 3 de marzo de 1861 (19 de febrero de 1861,
en el calendario juliano), acompañado por una serie
de decretos legislativos bajo el nombre general de Regulaciones
concernientes a los campesinos que dejan la dependencia
servil.
El Imperio ruso era una tierra de campesinos, que conformaban
por lo menos el 80% de la población total. Había dos
categorías principales de campesinos: aquellos que vivían
en tierras del Estado y aquellos que vivían en tierras
de propietarios privados. Solamente los últimos eran
siervos quienes, además de sus obligaciones para con
el Estado, también estaban obligados con el dueño de
las tierras, el cual tenía gran poder sobre sus vidas.
Para mediados del siglo XIX, menos de la mitad de los
campesinos rusos eran siervos.
_-_Kustodiev,_1907.jpg)
«Liberación de los campesinos (Lectura
del Manifiesto)». Borís Kustódiev, 1907.
|
En 1869, publicó la más importante de sus obras, Principios
de química, donde formulaba su famosa tabla periódica, traducida
a multitud de lenguas y que fue libro de texto durante muchos
años. Fue defensor de la ciencia aplicada y de los estudios
para mejorar las técnicas de producción industrial en numerosos
ámbitos. Contribuyó a la construcción de la primera refinería
petrolera de Rusia, planteó las primeras teorías sobre el
origen del petróleo y llegó a pronosticar que este recurso
se convertirá en un componente clave de la economía mundial.
En 1863, fue el primero en sugerir la idea de utilizar tuberías
para el transporte de combustible. Impulsó la importancia
del petróleo como materia prima para la petroquímica. Se le
atribuye la afirmación de que la quema de petróleo como combustible
"sería similar a prender una estufa de cocina con los billetes
de banco".
En 1876, fue enviado a Estados Unidos, para informarse sobre
la extracción del petróleo y ponerla luego en práctica en
el Cáucaso. El estudio del refino del petróleo lo llevó a
investigar el fenómeno de la atracción de las moléculas de
cuerpos homogéneos o diferentes, materia que estudió hasta
el día de su muerte. En 1887, publicó Estudio de las disoluciones
acuosas según el peso específico, donde concluye que las soluciones
contienen asociaciones de moléculas hidratadas en un estado
de equilibrio móvil, que se disocian de diferentes maneras
siguiendo el tanto por ciento de concentración. En 1887, emprendió
un viaje en globo en solitario para estudiar un eclipse solar.
El aparato estaba destinado a levantarse a suficiente altura
para ofrecer una visión sin obstrucciones al científico y
a un piloto. Una oportunidad única para estudiar la corona
solar. Sin embargo, el día del evento llovió, echando a perder
todos los planes de observación. A pesar de esto, se dice
que Mendeléyev sacó al piloto y demás cosas de la canasta
para poder realizar el vuelo. Científicamente, este viaje
no tuvo importancia alguna. El aerostato no logró sobrevolar
las nubes pero fue un éxito como reclamo publicitario.
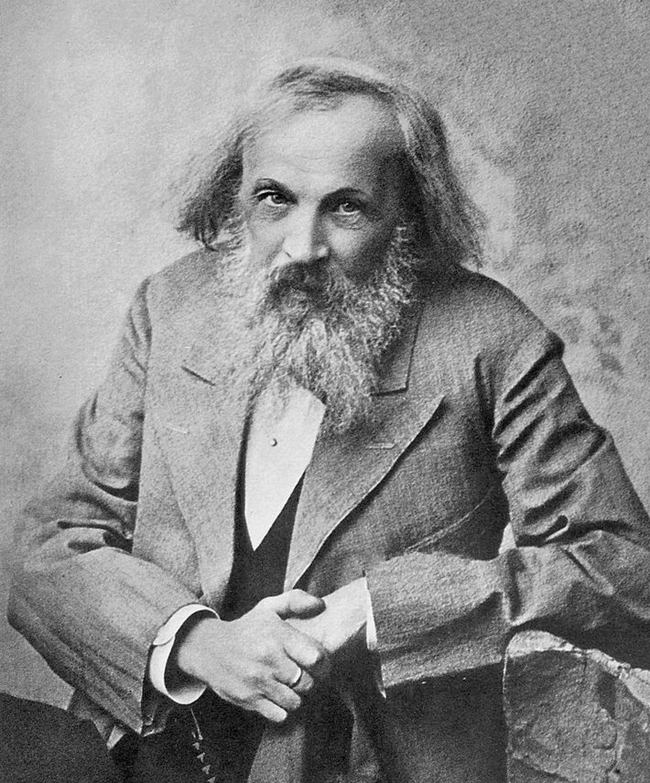
La dramática historia de un famoso científico que arriesga
su vida y se ve a obligado a realizar reparaciones para realizar
el primer vuelo en globo aerostático fue tan audaz que la
Academia de meteorología francesa le otorgó una medalla. Cabe
mencionar que también fue este ámbito uno de los muchos en
los que mostró interés el genio ruso. Además incentivó el
uso de fertilizantes en la agricultura y experimentó con varios
de ellos en su propia finca. Mejoró e inventó varios instrumentos,
entre ellos un aparato para medir la densidad de los líquidos.
Fue director de la Oficina de Pesos y Medidas de Rusia, e
influyó en la transición del país al sistema métrico. En 1889,
fue nombrado miembro honorario del Consejo de Comercio y Manufacturas.
En 1890, por un encargo del Ministerio de Guerra y Marina,
preparó una pólvora sin humo al pirocolodión. A petición de
la Armada rusa, realizó estudios sobre la experiencia europea
en la producción de pólvora sin humo y desarrolló su propia
fórmula, denominada “pyrocollodion”, así como también ayudó
al desarrollo de la industria del país.
No se sabe por qué la fórmula no se adoptó en Rusia y en
su lugar se exportó la técnica francesa. Hay quienes sostienen
que fue debido a la competencia entre funcionarios militares;
otros citan los estrictos requisitos para el proceso propuesto
por Mendeléyev. Sin embargo, se produjo y se importó una especie
de pólvora muy parecida a la suya a gran escala en los Estados
Unidos durante la Primera Guerra Mundial, incluso al posible
país de origen. En 1892, fue nombrado conservador científico
de la Oficina de Pesas y Medidas, en compensación por lo ocurrido
en la universidad. Después de un año, tras haberlo reorganizado,
fue nombrado director, lo que lo comprometió a realizar diversos
viajes, entre los que se encuentra el realizado a Londres,
donde recibió los doctorados honoris causa de las universidades
de Cambridge y Oxford.
|
¿Molibdeno? ¿Qué diablos es el molibdeno y para qué
narices necesito saberlo? Es probable que esta pregunta,
relacionada con este u otro elemento distinto e igual
de exótico, surgiera en la mente de todos los que disfrutaron
de la asignatura de Química durante su niñez. Y es posible
que a día de hoy aún no haya sido respondida. ¿Para
qué sirve la tabla periódica? Obviamente, para muchas
cosas. La tabla es a la química lo que la teoría de
la evolución a la biología, su fundamento básico a partir
de la cual se han realizado otros descubrimientos claves
para nuestro día a día.
Elaborada a finales del siglo XIX, incluye a los elementos
químicos conocidos por el ser humano, ya estén presentes
en la naturaleza, existieran en el pasado o hayan sido
sintetizados en un laboratorio. Muchos de los elementos
son fácilmente reconocibles. Todos sabemos para qué
sirve el oxígeno, que el carbono es la base de la vida
en la Tierra o que sin el aluminio sería imposible comprender
el mundo moderno. ¿Pero qué hay de otros mucho más exóticos
y a priori irrelevantes para nuestras vidas? ¿Qué pasa
con el estroncio, con el paladio, con el rutenio, con
el rubidio o con el vanadio?
Consciente de lo ajena que resultaba la tabla periódica
para las personas comunes y corrientes, Keith Enevoldsen,
un ingeniero de software estadounidense, decidió emprender
hace ya varios años un apasionante y admirable proyecto:
la tabla periódica for dummies. O lo que es lo mismo:
una tabla periódica donde a cada elemento se añade un
objeto/elemento cotidiano, presente en nuestras vidas
diarias, y para el que son indispensables.
.jpg)
|
En 1902, viajó a París y visitó a Marie y Pierre Curie, en
su laboratorio. Observó el experimento de la fosforescencia
del sulfuro de zinc, debida a los rayos X, y concluyó que
“en los cuerpos radiactivos existe un gas etéreo que provoca
vibraciones luminosas y que entra y sale de los cuerpos como
un cometa entra y sale del sistema solar”. No lo terminó de
convencer la teoría de la radiactividad y la estructura del
átomo. Consideraba la radiactividad como una propiedad o un
estado de las sustancias, mientras que los átomos y moléculas
no existían realmente, aunque sí lo hacía la energía. Viajó
por toda Europa visitando a diversos científicos. Hizo aportes
a la investigación y construcción naval y a los viajes marítimos
al Ártico. Participó en la elaboración de la navegación por
el Ártico y en la creación de nuevos tipos de buques rusos.
Asimismo, participó en el diseño del Yermak, el primer rompehielos
del Ártico. La idea de hacer que los territorios del norte
de Rusia fueran accesibles por mar era muy atractiva para
el científico ilustrado.
En Rusia, nunca se le reconoció, debido a sus ideas liberales,
por lo que nunca fue admitido en la Academia Rusa de las Ciencias.
Sin embargo, en 1955 se nombró mendelevio (Md) al elemento
químico de número atómico 101, en su honor.

Los campesinos en la Rusia del siglo XIX.
Dmitri Mendeléyev estuvo a punto de conseguir un Premio Nobel,
circunstancia que finalmente se le resistió. El Comité Nobel
de Química recomendó a la Academia Sueca de Ciencias que el
máximo galardón se le concediera al creador de la tabla periódica
y, a pesar de que son muy pocas las ocasiones en las que la
Academia ignora las recomendaciones del Comité, desafortunadamente
esta fue una de ellas. En 1906, la casi totalidad de los miembros
de la Real Academia de las Ciencias de Suecia estaban de acuerdo
en que el justo merecedor del Premio Nobel de Química de ese
año debía ser el ruso Dmitri Mendeléyev, al que habían hecho
miembro de la Academia un año antes y a quien consideraban
como una de las mentes más brillantes, por lo que debía de
ser recompensando (entre otras muchas cosas) por poner los
cimientos de la tabla periódica de elementos. Inesperadamente,
poco antes de ser anunciado el nombre de Mendeléyev, como
ganador del Premio Nobel, la Academia cambió de opinión y
se lo concedió al químico francés Henri Moissan. El motivo
de esa repentina y sorprendente decisión estuvo causada por
la intervención de Peter Klason, académico que discrepó de
la conveniencia de otorgar el Nobel al químico ruso por algo
que había realizado cuatro décadas atrás (en 1869), por lo
que propuso el nombre de Moissan por sus investigaciones sobre
el aislamiento del flúor. Pero quien realmente estaba detrás
del empeño de que a Dmitri Mendeléyev no se le concediera
el Premio Nobel y había convencido a Klason para que fuese
discordante con el resto de académicos fue Svante August Arrhenius,
ganador del Premio Nobel en 1903 por la teoría de la disociación
electrolítica.
Arrhenius, a pesar de no ser miembro de la Academia, tenía
mucha influencia entre varios de sus colegas, y poco a poco
logró ir convenciéndolos gracias a la inestimable colaboración
que le prestó Peter Klason. Y es que todo ese empeño para
que a Mendeléyev no se le concediera el premio venía originado
por un conflicto personal que Arrhenius tenía desde hacía
tres años atrás, cuando le concedieron a él el Nobel y su
colega ruso criticó duramente y en público su teoría de la
disociación electrolítica. Un año después de que se truncara
ese reconocimiento a su labor, el científico murió.
--------------------------------------------------------------------------------------------------------------


--------------------------------------------------------------------------------------------------------------
Dmitri Mendeléyev nació y creció en la tradicional e inmovilista
Rusia de los zares, y siempre estuvo señalado dentro de su
país, por entonces todo un imperio, como una persona liberal,
algo que le perjudicó dentro de sus fronteras. Creció en la
fe ortodoxa, aunque su madre le animó desde pequeño a "buscar
la verdad divina paciencia y científica". Más adelante, abandonó
esta fe y abrazó el deísmo, que acepta el conocimiento de
Dios a través de la razón y la experiencia personal, en lugar
a través de la revelación directa, la fe o la tradición. La
economía y la política social fueron algunos de sus temas
favoritos y fue un gran defensor del proteccionismo y del
desarrollo de las industrias nacionales.
La ordenación de los elementos químicos en una tabla periódica
fue el gran aporte de Mendeléyev a la ciencia, pues esta agrupación
por pesos atómicos y valencias permite observar una regularidad
en las propiedades de los elementos. Además, intuyó que aún
faltaban elementos por descubrirse, y por este motivo había
huecos en la tabla, y señaló las propiedades que éstos debían
poseer. En 1860, inició sus estudios sobre la confección de
un manual de química. Para ello, elaboró unas tarjetas donde
iba enumerando las propiedades más significativas de los elementos
conocidos hasta entonces. Al ordenar estas tarjetas, pudo
comprobar que sesenta aparecían en fila y la mayoría de los
elementos estaban ordenados en orden creciente respecto a
su masa atómica relativa. De esta manera, los elementos con
propiedades químicas análogas, quedaban ubicados en grupos
verticales. Con anterioridad, en 1817, J. W. Döbereiner, cuando
aún se conocían muy pocos elementos químicos, intuyó la existencia
de las tríadas o grupos de elementos con propiedades parecidas,
con la característica de que el peso atómico del elemento
central era la media aritmética aproximada de los pesos atómicos
de los elementos extremos; éste era el caso, por ejemplo,
del litio, sodio y potasio o del cloro, bromo y yodo o del
azufre, selenio y telurio. También, A. E. de Chancourtois,
en 1862, estableció una hélice telúrica o tornillo telúrico,
situando los elementos químicos en orden de pesos atómicos
crecientes sobre una hélice, con 16 elementos por vuelta.
De esta manera, observó que muchos de los elementos de propiedades
análogas quedaban ubicados en la generatriz del cilindro,
unos encima de otros; enunció de esta manera una ley que decía
que las propiedades de los elementos son las propiedades de
los números. En 1868, J. A. Newlands había ordenado los elementos
en agrupaciones lineales, enunciando su ley de las octavas,
en la que afirmaba que, si se situaban todos los elementos
en un orden creciente de pesos atómicos después de cada siete
elementos, aparecía un octavo cuyas propiedades son similares
a las del primero, pero Dimitri desconocía este trabajo y,
por otra parte, el suyo le superó con creces.

Dmitri Mendeléyev en 1897.
La elaboración de la tabla como tal se realizó a lo largo
de los años 1868-1869. Una primera versión se presentó a la
Sociedad Química Rusa, donde aparecía de forma explícita la
idea de que las propiedades de los elementos pueden representarse
a través de funciones periódicas de sus pesos atómicos. Simultáneamente
a Mendeléyev, pero de forma independiente, J. L. Meyer llegó
a una clasificación prácticamente igual, pero se basó en las
propiedades físicas de los elementos y no en las químicas,
como hizo Mendeléyev.
|
El gran mérito de Mendeléyev estriba en la importancia
que dio a la semejanza de grupo, llegando a las siguientes
conclusiones:
- considera incorrectos ciertos pesos atómicos y los
altera, pues no se ajustaban al esquema general de la
tabla;
- predice nuevos estados de valencia de algunos elementos.
- invierte el orden de los pesos atómicos crecientes
cuando conviene, como en el caso del telurio y el yodo.
- deja vacantes algunas posiciones de la tabla, para
ubicar en ellas elementos aún no descubiertos y que
pensó que existirían si realmente se verificaba la ley
de la periodicidad.
|
Partiendo de este carácter periódico de la tabla, predijo
las propiedades de algunos elementos desconocidos, y en concreto
los que debían ocupar las posiciones inmediatamente inferiores
del boro, aluminio y silicio, y a los que él denominó: eka-boro,
eka-aluminio y eka-silicio, respectivamente. Poco tiempo después,
el descubrimiento del eka-aluminio, designado como galio (de
número atómico 31, descubierto en 1875 por L. de Boisbaudran),
el eka-boro, denominado escandio (de número atómico 21, descubierto
en 1879 por L. F. Nilson), y el eka-silicio, designado como
germanio (el número 32, descubierto por Winkler, en 1886),
le dieron la razón. Posteriormente, se añadieron a la tabla
los gases nobles y los transuránidos y, si bien cuando comenzaron
a descubrirse los primeros gases inertes pareció que la teoría
de la periodicidad se derrumbaba, se observó que, al intercalar
en la relación de los elementos por orden de pesos atómicos
crecientes, era suficiente con invertir el argón y el potasio
para que todos encajaran en una columna, ubicada entre la
de los halógenos y la de los metales alcalinos. Después, Moseley
y Bohr dieron una explicación a esta ordenación, usando el
concepto de estructura atómica. La periodicidad de las propiedades
observadas por Mendeléyev se debe al número de electrones
en los orbitales de sus últimos niveles.
| Dmitri Mendeléyev publicó su tabla periódica con todos
los elementos conocidos y predijo varios de los nuevos
elementos para completar la tabla. Solo unos meses después,
Meyer publicó una tabla prácticamente idéntica. Algunos
consideran a Meyer y Dmitri Mendeléyev los cocreadores
de la tabla periódica. Este último logró predecir con
precisión las cualidades de lo que llamó eka-silicio,
eka-aluminio y eka-boro (germanio, galio y escandio, respectivamente). |
El sistema periódico es la clasificación de todos los elementos
químicos, naturales o creados artificialmente. A medida que
se perfeccionaron los métodos de búsqueda, el número de elementos
químicos conocidos fue creciendo sin cesar y surgió la necesidad
de ordenarlos de alguna manera. Se realizaron varios intentos,
pero el intento decisivo lo realizó Mendeléyev, que creó lo
que hoy se denomina sistema periódico. Mendeléyev ordenó los
elementos según su masa atómica, situando en una misma columna
los que tuvieran algo en común. Al ordenarlos, se dejó llevar
por dos grandes intuiciones; alteró el orden de masas cuando
era necesario para ordenarlos según sus propiedades y se atrevió
a dejar huecos, postulando la existencia de elementos desconocidos
hasta ese momento.
|
"Falta un elemento en este sitio y, cuando sea
encontrado, su peso atómico lo colocará antes del titanio.
El descubrir la laguna colocará los últimos elementos
de la columna en los renglones correctos; el titanio
corresponde con el carbono y el silicio."
Mendeléyev, audaz y visionario.
|
Con todo, su principal logro investigador fue el establecimiento
del llamado sistema periódico de los elementos químicos, o
tabla periódica, gracias al cual culminó una clasificación
definitiva de los citados elementos (1869) y abrió el paso
a los grandes avances experimentados por la química en el
siglo XX. Aunque su sistema de clasificación no era el primero
que se basaba en propiedades de los elementos químicos, como
su valencia, sí incorporaba notables mejoras, como la combinación
de los pesos atómicos y las semejanzas entre elementos, o
el hecho de reservar espacios en blanco correspondientes a
elementos aún no descubiertos como el eka-aluminio o galio
(descubierto por Boisbaudran, en 1875), el eka-boro o escandio
(Nilson, 1879) y el eka-silicio o germanio (Winkler, 1886).
Actualmente se emplea el formato de la tabla elaborada por
Werner, con los lantánidos y actínidos en columnas propias.
Los últimos años de su carrera los pasó en la enfermería
debido a un diagnóstico de tuberculosis. Falleció el 2 de
febrero de 1907, casi ciego. Se considera a Mendeléyev un
genio, no sólo por el ingenio que mostró para aplicar todo
lo conocido y predecir lo no conocido sobre los elementos
químicos y plasmarlo en la tabla periódica, sino por los numerosos
trabajos realizados a lo largo de toda su vida en diversos
campos de la ciencia, agricultura, ganadería, industria, petróleo,
etc.
|
En 1905 Dmitri Mendeléyev fue premiado con la Medalla
Copley, es un premio que otorga anualmente la Real Sociedad
de Londres a una persona física como reconocimiento
al trabajo científico por sus logros sobresalientes
en las ciencias físicas o biológicas. En 1955 se nombró
mendelevio (Md) al elemento químico de número atómico
101 en la tabla periódica, en su honor por sus investigaciones
en esa materia. En su honor se erigió el Monumento a
la farmacia DI Mendeléyev en San Petersburgo. El cráter
lunar Mendeleev lleva este nombre en su memoria. El
asteroide (2769) Mendeleev también conmemora su nombre.

Mendeleev es un gran cráter de impacto
que se encuentra en la cara oculta de la Luna, por lo
que no es visible desde la Tierra. El borde sur de esta
llanura amurallada atraviesa el ecuador lunar. Invadiendo
el borde oriental de Mendeleev se halla el cráter Schuster.
Casi en el lado opuesto, el cráter Hartmann, más pequeño,
se introduce en sector oeste-suroeste del brocal.
|
En 1869 el químico Dimitri Mendeléiev presentó su sistema
de ordenación de los elementos. Ahora se ha convertido en
un icono de la ciencia y la cultura y para conmemorar su siglo
y medio de vida, Naciones Unidas ha declarado 2019 como el
Año Internacional de la Tabla Periódica.

Mendeléyev nunca fue muy reconocido en vida
en Rusia debido a sus ideas liberales, por lo que nunca fue
admitido en la Academia Rusa de las Ciencias. Sin embargo,
en 1955 se nombró mendelevio (Md) al elemento químico de número
atómico 101, en su honor.

Primeros esbozos ...

Franqueo soviético con sello en honor a Mendeléyev.
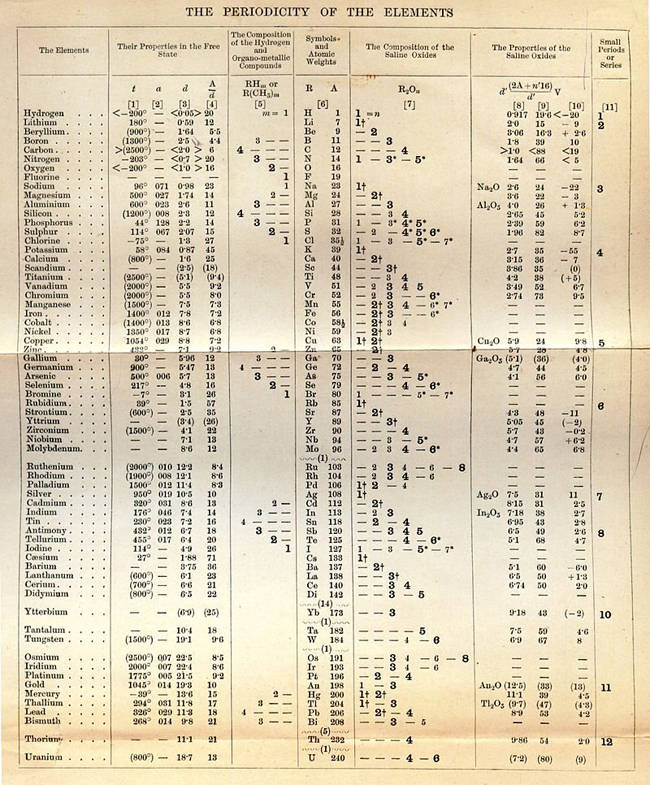
Esta tabla, que muestra la periodicidad de las
propiedades de muchos elementos químicos, procede de la primera
edición en inglés de los "Principios de Química" de Mendeléyev,
traducido de la quinta edición rusa. El gran éxito de Mendeléyev
en la elaboración de su tabla periódica fue la predicción
de elementos que aún no habían sido descubiertos aún en 1891.
|
¿Qué es un elemento químico? Es la parte de la materia
constituida por átomos de la misma clase y que no puede
ser descompuesta en otras más simples mediante una reacción
química. Cualquier ser, vivo o inerte, está constituido
por elementos químicos. Por ejemplo, en un teléfono
móvil se pueden encontrar alrededor de 30 elementos
distintos, y en el cuerpo humano casi el doble: 59 elementos.
|
Hasta ahora se han descubierto y confirmado
118 elementos químicos. Los cuatros últimos son nihonio, moscovio,
teneso y oganesón. Grandes laboratorios de Japón, Rusia, Estados
Unidos y Alemania compiten por ser los primeros en obtener
los siguientes: el 119 y el 120. En 2016 la tabla sumó cuatro
nuevos elementos: el 113 (nihonio), el 115 (moscovio), el
117 (téneso) y el 118 (oganesón).
La IUPAC (Unión Internacional de Química Pura
y Aplicada), la organización encargada de aprobar los cambios
en la tabla periódica, ya había aceptado la denominación de
estos nuevos elementos recién añadidos oficialmente a la tabla
periódica. Entre las condiciones, la entidad estipula que
los nombres deben estar relacionados con un concepto mitológico,
una región geográfica o un científico.
Ninguno de los cuatro elementos puede encontrarse
en la naturaleza. Todos ellos han sido ‘creados’ por el hombre,
descubiertos por la descomposición provocada al golpear entre
sí núcleos de elementos superpesados radiactivos. El nihonio
(113) proviene de la palabra nihon (Japón en japonés), pues
corresponde a un hallazgo realizado por un equipo de científicos
del Instituto Riken.
Los demás elementos nuevos hacen referencia
a Rusia y Estados Unidos, pues son el resultado de una investigación
conjunta llevada a cabo por científicos del Joint Institute
for Nuclear Research of Dubna, (Rusia) y del Laboratorio Nacional
Lawrence Livermore de California.
Moscovio (115), hace referencia a Moscú; téneso
recibe su nombre a Tennessee (EE.UU.), el segundo estado de
EE.UU. en aparecer en la tabla periódica después de California
(Cf, 98). Finalmente, oganesón (118), debe su denominación
al físico nuclear ruso Yuri Oganessian, director del equipo
científico que lo descubrió.
--------------------------------------------------------------------------------------------------------------


--------------------------------------------------------------------------------------------------------------
Ununennio, también conocido como eka-francio
o elemento 119, es el hipotético elemento químico con el símbolo
Uue y el número atómico 119. Ununennio y Uue son el nombre
y el símbolo de la IUPAC sistemático temporal, respectivamente,
que se utilizan hasta que se descubre el elemento, se confirma
y se decide un nombre permanente. En la tabla periódica de
los elementos, se espera que sea un elemento de bloque s,
un metal alcalino, y el primer elemento en el octavo período.
Es el elemento más ligero que aún no ha sido sintetizado.
La posición del ununennio como séptimo metal
alcalino sugiere que tendría propiedades similares a sus congéneres
más ligeros: litio, sodio, potasio, rubidio, cesio y francio.
Sin embargo, los efectos relativistas pueden hacer que algunas
de sus propiedades difieran de las esperadas de una aplicación
directa de tendencias periódicas. Por ejemplo, se espera que
el ununennio sea menos reactivo que el cesio y el francio
y que tenga un comportamiento más cercano al del potasio o
el rubidio, y aunque debería mostrar el característico estado
de oxidación +1 de los metales alcalinos, también se prevé
que muestre el estado de oxidación +3, que no se conoce en
ningún otro metal alcalino.
Se trata de experimentos costosísimos que en
definitiva, si tienen éxito, logran crear un elemento que
se mantiene cohesionado por apenas unas milésimas de segundos.
¿Será la colisión de vanadio y curio la combinación perfecta
para obtener el elemento 119.

Escultura en honor a Mendeléyev y su tabla periódica,
situada en Bratislava (Eslovaquia).
El Unbinilio o eka-radio, es el nombre temporal
de un elemento químico de la tabla periódica aún no descubierto,
cuyo símbolo provisional es Ubn y su número atómico 120. Es
de interés porque es parte de la hipotética isla de estabilidad,
siendo el isótopo 318 el más estable de los que pueden crearse
con los métodos actuales. Usando el modelo esférico de formación
de capas, el elemento 120 sería el más pesado en una isla
de estabilidad, y también, junto al 114, el más esférico.
De los resultados de los experimentos del equipo alemán del
GSI se deduce que la supuesta isla de estabilidad para Z=120
y N=184 (120 protones y 184 neutrones) no será excepcionalmente
elevada respecto a las regiones vecinas.
El Unbinilio sería muy reactivo, de acuerdo
con las propiedades periódicas conocidas, pues este elemento
pertenece al grupo de los metales alcalinotérreos. Sería mucho
más reactivo que otros elementos más ligeros de su grupo.
Reaccionaría violentamente con el aire para formar óxido de
unbinilio, y con el agua para formar hidróxido de unbinilio,
que sería una base fuerte.
| ¿Cuándo completa Mendeléiev su tabla? La fecha oficial
–tomada como referencia para el aniversario de este año–
es el 1 de marzo de 1869 según el calendario gregoriano,
porque según el calendario juliano utilizado en Rusia
en aquella época sería el 17 de febrero, como aparece
en su documento titulado "La experiencia de un sistema
de elementos basados en su peso atómico y similaridad
química". |
A mediados del siglo XIX ya se conocían 63 elementos,
pero los químicos no se ponían de acuerdo sobre la terminología
y cómo ordenarlos. Para resolver estas cuestiones se organizó
en 1860 el primer Congreso Internacional de Químicos en Karlsruhe,
en Alemania, una reunión que resultaría trascendental. Allí
el italiano Stanislao Cannizzaro estableció de forma clara
el concepto de peso atómico-masa atómica relativa de un elemento-,
en el que se inspirarían tres jóvenes participantes en el
congreso -William Odling, Julius Lothar Meyer y Dimitri Ivánovich
Mendeléiev para crear las primeras tablas.
|
¿El elemento mas denso? Se trata del Osmio,
cuya densidad es 22,6 veces la densidad del agua pura.
Esto quiere decir que, a presión atmosférica, un litro
de Osmio pesa 22,6 kilogramos. Entre los más pesados
hay 5 elementos que superan los 20 kg por litro como
el Neptunio, Renio el Platino y el Iridio.

El elemento más caro es el Californio. Esto se debe
a que es un elemento sintético, 1 g de Californio cuesta
cerca de 40 millones de euros. Cabe destacar no obstante
que uno de los elementos más caros es el Carbono, pero
solo cuando se encuentra en forma de diamante. El oro,
símbolo de la riqueza, no es tan caro. Unos 90 euros
el gramo, y está por debajo de otros metales como el
Rodio, 99 euros/gramo y el Platino, 105 euros/gramo.
Debe tenerse en cuenta que estos metales cotizan en
bolsa y que sus valores son variables.

En la corteza terrestre el elemento más abundante es
el Oxígeno, en segundo lugar se encuentra el Silicio,
mientras que la tercera posición es ocupada por el Aluminio.
Fuera del planeta, en nuestra galaxia, el elemento más
abundante son los sencillos Hidrógeno y Helio.

El silicio es un elemento químico metaloide,
número atómico 14 y situado en el grupo 14 de la tabla
periódica de los elementos de símbolo Si. Es el segundo
elemento más abundante en la corteza terrestre después
del oxígeno.
El elemento más reactivo es el Flúor que se combina
prácticamente con todos los demás miembros de la tabla
periódica. A este elemento le falta un electrón para
completar el octete y hace cualquier cosa con tal de
conseguirlo.

|
|
--------------------------------------------------------------------------------------------------------------



--------------------------------------------------------------------------------------------------------------
|

--------------------------------------------------------------------------------------------------------------
|























_-_Kustodiev,_1907.jpg)
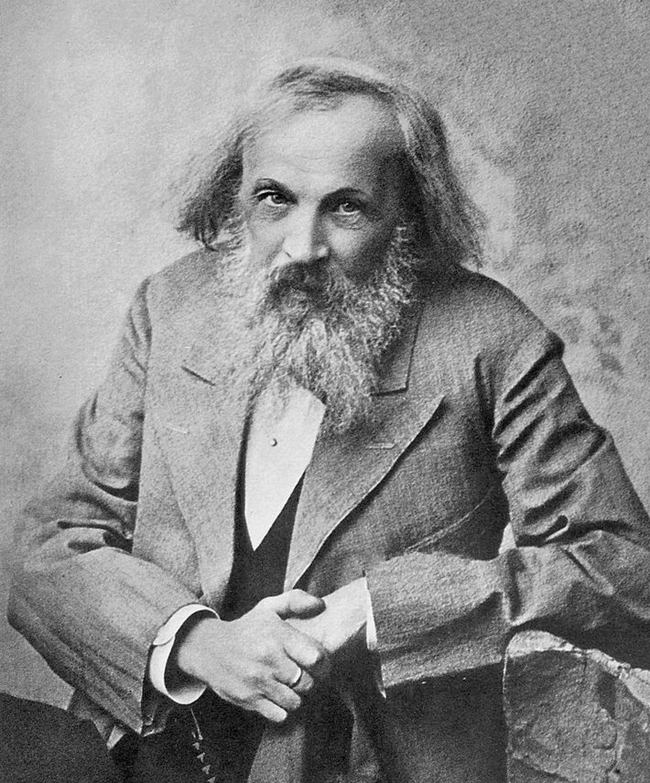
.jpg)























.jpg)








