|
Los científicos del Instituto Sloan Kettering
de Nueva York, liderado por el oncólogo español Joan Massagué,
han descubierto que la capacidad de los cánceres para hacer
metástasis depende de su capacidad para cooptar las vías naturales
de reparación de heridas, lo que abre una vía para su posible
tratamiento. El adelanto científico, publicado en la revista
Nature Cancer y que ha sido comunicado también por el propio
Sloan Kettering Cancer Center, proporcionan un marco novedoso
para pensar sobre la metástasis y cómo tratarla.
De entrada hay que recordar que la metástasis,
que es la propagación del cáncer a otras regiones del cuerpo,
es responsable del 90 % de las muertes por cáncer. Sin embargo,
no se sabe mucho sobre lo que hace que las células cancerosas
sean capaces de hacer metástasis.
Ahora, este estudio de investigadores del Sloan
Kettering Institute concluye que las células iniciadoras de
metástasis emplean un truco para propagarse: cooptan las capacidades
naturales de curación de heridas del cuerpo.
"Ahora entendemos la metástasis como la regeneración
del tejido equivocado -el tumor- en el lugar equivocado, los
órganos vitales distantes", dice Joan Massagué , director
del Instituto Sloan Kettering y el director de la investigación
sobre un asunto en el que lleva 30 años investigando.

Anteriormente había indicios de que los cánceres
podrían utilizar vías de curación de heridas para apoyar su
crecimiento. En la década de 1980, el investigador Harold
Dvorak denominó a los tumores "heridas que no sanan". Pero
los nuevos hallazgos presentan la primera imagen detallada
de cómo funciona este proceso en el nivel de células y moléculas.
Aunque la metástasis es mortal, no es algo que
las células cancerosas puedan hacer fácilmente. Para propagarse,
las células cancerosas deben separarse con éxito de sus vecinas,
atravesar las capas de tejido que las separan de la circulación,
nadar o arrastrarse a una nueva ubicación en el cuerpo a través
de la sangre o el líquido linfático, salir de estos vasos,
luego echar raíces y comenzar a crecer en el nueva ubicación.
| Duplicar la investigación en cáncer elevaría la supervivencia
del 53% al 70%. El primer estudio que aglutinó
en 2018 los datos de investigación en cáncer en España
constató que el esfuerzo científico no se corresponde
siempre con los cánceres con mayor mortalidad o prevalencia
y que el peso de la financiación pública es muy escaso
frente al gasto privado y filantrópico. En la década de
1980, el investigador Harold Dvorak denominó a los tumores
"heridas que no sanan". Pero los nuevos hallazgos presentan
la primera imagen detallada de cómo funciona este proceso
en el nivel de células y moléculas. |
En cada paso de este proceso, la mayoría de
las células cancerosas sueltas mueren. Menos del 1 % de todas
las células cancerosas que se desprenden de un tumor finalmente
formarán metástasis medibles. "Una vez que las células cancerosas
aprenden a sobrevivir al estrés de en un ambiente extraño,
es muy difícil deshacerse de ellas", dice Karuna Ganesh ,
médico-científica del Programa de Farmacología Molecular de
SKI y una de las autoras del artículo. "Son una entidad completamente
diferente del tumor en el que comenzaron".
Ganesh y sus colegas querían entender qué permite
a algunas células sobrevivir a este viaje estresante. Se centraron
en una molécula llamada L1CAM, que estudios previos del laboratorio
de Massagué habían demostrado que es necesaria para que numerosos
tipos de células cancerosas hagan metástasis con éxito en
los órganos.
Los tejidos sanos normales no suelen producir
L1CAM, pero los cánceres avanzados sí lo hacen. Lo que desencadena
exactamente la L1CAM ha sido hasta ahora un misterio. Al observar
los tejidos tumorales humanos con un microscopio, fue claro
para los investigadores que dividir las células con L1CAM
era más común en áreas donde se rompía una capa epitelial,
es decir, herida. Esto llevó a los científicos a preguntarse
si se requiere L1CAM para la reparación normal de heridas,
como ocurre en el intestino después de la colitis. Usando
un modelo de colitis en ratones, descubrieron que, de hecho,
este era el caso.
En definitiva, el avance concreta que las metástasis
no se derivan de mutaciones genéticas sino por una reprogramación
de las células que les permite regenerar creando metástasis.
|
Es un mes de triunfos médicos. El CNIO descubre
un tratamiento contra el más agresivo de los cánceres
por exposición al amianto Dos medicamentos combinados
son efectivos en ratones contra un tipo de tumor cancerígeno
muy agresivo que se produce, sobre todo, por la exposición
al amianto, según informa el Centro Nacional de Investigaciones
Oncológicas. Ahora este tumor no tiene cura y la supervivencia
es corta.
La buena noticia es que ambos fármacos se están probando
ya en pacientes humanos para otros tipos de cáncer y
esto podría acelerar su aprobación como posible tratamiento
contra el “mesotelioma”, según acaba de explica el CNIO
en un comunicado. Esta nueva investigación aporta "evidencias,
en ratón y en líneas celulares humanas, de la posible
eficacia de dos compuestos ya conocidos. Ahora nos gustaría
iniciar ensayos en humanos cuanto antes", ha asegurado
el jefe del Grupo de carcenogénesis epitelial del CNIO,
Paco Real.

El mesotelioma es un cáncer poco frecuente y reconocido
como enfermedad profesional, porque aparece tras varias
décadas de exposición al amianto, un material usado
en España sobre todo en los años setenta en el sector
de la construcción y que se prohibió en 2001, precisamente,
por su potente efecto cancerígeno. La supervivencia
media de los pacientes con mesotelioma sarcomatoide
(el más agresivo) es ahora de apenas 18 meses.
El resultado de la investigación fue una sorpresa en
"gran medida inesperada", porque, en realidad, estos
científicos del CNIO estaban tratando de “crear” ratones
que desarrollaran cáncer de vejiga. Con este fin, los
investigadores manipularon dos genes, pero en lugar
del tumor esperado, los roedores sufrieron un mesotelioma
sarcomatoide muy agresivo. Entonces, los investigadores
buscaron la causa molecular de esa agresividad, que
identificaron en la sobreactivación de dos proteínas.
Y, determinada la causa, sólo les quedaba encontrar
medicamentos contra esas proteínas que ya estuvieran
siendo ensayados en pacientes humanos.
Paco Real y su equipo fueron noticia en 2016, cuando
demuostraron que el gen BPTF es crucial para que el
gen MYC genere tumores. El gen MYC está implicado en
casi todos los tipos de cáncer y además es uno de los
genes que genera más dificultades para desarrollar tratamientos.
Cada vez más grupos de investigación están realizando
ensayos preclínicos con resultados prometedores para
regular este oncogén. Expertos del Centro Nacional de
Investigaciones Oncológicas (CNIO) dieron un paso más
en este sentido ya que se identificó una proteína
indispensable para que MYC produzca cáncer en modelos
de ratón.
Utilizando un modelo de ratón de cáncer de páncreas
dependiente de MYC, los investigadores demostraron que
inhibir la acción de BPTF reduce la agresividad de los
tumores. Como explicó Paco Real, jefe del Grupo
de Carcinogénesis Epitelial del CNIO, se descubrió
que “BPTF es un eslabón fundamental para que MYC lleve
a cabo sus funciones”. Más en concreto, “al disminuir
un 50 por ciento la función de BPTF, se retrasa el crecimiento
de los tumores sin que haya afectación en células normales".
Así que el desarrollo del tumor ocurre más tarde y la
progresión del tumor es más lenta. A pesar de que el
papel de MYC en la génesis de los tumores es conocido
desde hace tiempo, este gen presenta una serie de dificultades
para convertirlo en una diana terapéutica.
Uno de los principales retos para atacar MYC es que
generalmente éste no se encuentra mutado en cáncer.
“Cuando hay una mutación de un gen, es más sencillo
atacarla porque la proteína presente en la célula tumoral
es diferente de la proteína regulada por el mismo gen
y presente en la célula normal”, dijo Real. Lo que ocurre
con MYC es que la proteína es la misma en la célula
normal y la patológica, con la diferencia de que en
esta última funciona de forma incorrecta. Además, “MYC
es realmente un controlador general de la actividad
de la célula; es uno de los pocos genes que, si lo eliminas,
hace inviable a la célula”, añadió este experto.
Por tanto, al atacarlo se puede poner en riesgo a las
células normales.
Se estima que toda la familia de los genes MYC está
implicada como mínimo en el 50 por ciento de los tumores.
A veces de forma directa, pero otras veces MYC forma
parte de una cadena de acontecimientos moleculares que
causan que los tumores crezcan. “MYC funciona como un
regulador transcripcional que se une al ADN y de esa
manera regula la expresión de genes que son importantes
para el crecimiento, la diferenciación y la muerte celular”,
comentó Real. Los investigadores se centraron
en G-MYC, uno de los genes de esta familia. La proteína
BPTF desempeña un papel crucial para determinar a qué
regiones del genoma se une. “Es necesaria para que MYC
se una a regiones del genoma que son importantes para
la activación de genes que participan en cáncer”, explicó
Real. Al eliminar una de las dos copias del gen que
regula BPTF, “la acción de MYC ya no se puede llevar
a cabo”, añade Real. Los investigadores también detectaron
mutaciones en BPTF en cáncer de vejiga, y demostraron
que cuando se inactiva BPTF las células cancerosas no
pueden crecer. Real señaló que el objetivo de
su grupo es “aclarar los mecanismos de acción de BPTF
y MYC y buscar fármacos que inhiban la capacidad de
la proteína BPTF para unirse a MYC”.
|
A principios de 2019, investigadores del Vall d'Hebron Instituto
de Oncología (VHIO) lograron desarrollar un nuevo tratamiento,
que se ha probado con éxito en ratones y que esperan probar
en fase de ensayo clínico en humanos en 2020, para inhibir
un gen que causa, entre otros, el cáncer de pulmón más agresivo.
El equipo liderado por Laura Soucek, investigadora del Grupo
de Modelización de Terapias Anti-Tumorales en Ratón del VHIO
y cofundadora y directora ejecutiva de Peptomyc SL, ha logrado
un nuevo hallazgo para atacar a Myc, un gen clave en el desarrollo
de la mayoría de tumores.
Soucek ha recordado que comenzó a desarrollar su idea de
inhibir a Myc, hace 20 años, y para ello diseñó Omomyc, un
transgén que inhibía esta proteína sin generar efectos adversos
y que ahora ha conseguido convertir en un fármaco administrable.
Según publicó la revista 'Science Transational Medicine',
en un artículo cuya primera autora es Marie-Eve Beaulieu,
anteriormente investigadora en el grupo de Soucek y ahora
directora científica de Peptomyc SL, han demostrado que Omomyc
puede usarse como terapia anti-Myc contra el cáncer de pulmón
no microcítico, el subtipo más agresivo y mortal en mujeres
y hombres.
Soucek y su equipo han conseguido producir Omomyc como miniproteína
y administrarlo como fármaco antitumoral en modelos de ratón
con cáncer de pulmón no microcítico. Según Soucek, "la administración
de Omomyc por vía intranasal se tolera bien, reduce el grado
tumoral y bloquea su crecimiento, además de que también puede
ser administrado por vía sanguínea". "En este estudio demostramos
que Omomyc puede ser administrado por vía intravenosa sin
producir efectos secundarios en el ratón e impidiendo el crecimiento
tumoral, hecho que nos permite extender esta nueva terapia
para tratar otros tipos de cáncer y sus metástasis", según
Soucek.

Laura Soucek lidera el equipo de investigadores
del Vall d'Hebrón.
La importancia del gen Myc en el desarrollo de cáncer es
conocida desde hace tiempo ya que es un factor de transcripción
implicado en múltiples procesos biológicos esenciales para
el desarrollo del cáncer: interviene en la proliferación y
división celular, en el metabolismo y en la regulación de
la respuesta inmunitaria. Así, según Soucek, inhibir Myc tiene
el potencial de atacar las células cancerígenas a través de
varios mecanismos: primero bloquea la proliferación celular
y limita que el tumor crezca, luego impide que actúe en el
metabolismo de la glucosa, lípidos y formación de nuevas estructuras
de la célula, afectando así al crecimiento y supervivencia
celular, y por último facilita que las células tumorales sean
detectadas y atacadas por el sistema inmunitario.
Actualmente no existe ningún inhibidor de Myc disponible
para tratar el cáncer en la práctica clínica."Los beneficios
de inhibir Myc eran conocidos, pero faltaba la herramienta
precisa. Ahora hemos demostrado que Omomyc, en su nueva forma
de miniproteína, tiene capacidad para penetrar hasta el núcleo
e inhibir Myc para bloquear la progresión del tumor", ha precisado
Marie-Eve Beaulieu. El estudio también ha combinado la administración
de Omomyc con paclitaxel (terapia estándar para tratar el
cáncer de pulmón), sin efectos secundarios añadidos ni interacciones
farmacológicas, con mayor bloqueo del crecimiento tumoral
respecto a las dos terapias individuales y prolongando la
supervivencia de los ratones.
Según Soucek, el fármaco también tiene la capacidad de reclutar
células del sistema inmunitario en el foco tumoral. Este efecto
sobre el sistema inmunitario, según la investigadora, abre
nuevas líneas de investigación combinando este inhibidor de
Myc con la inmunoterapia, una estrategia terapéutica novedosa
que está demostrando un gran potencial en diferentes tumores.
"Después de validar la eficacia de este nuevo fármaco para
tratar tumores de pulmón en modelos preclínicos, estamos ahora
escalando la producción y la purificación de la miniproteína
a nivel industrial para tratar a pacientes reclutados para
futuros estudios clínicos", ha concluido Beaulieu, que espera
que estos ensayos clínicos empiecen en 2020.
|
El Día Mundial del Cáncer es el 4 de Febrero. Acceder
al diagnóstico, tratamiento y cuidado del cáncer que
podría salvar vidas debe ser igual para todos, sin importar
donde viva, cuáles son sus ingresos, su origen étnico
o género. Los gobiernos deben ser responsables y el
liderazgo nacional sobre políticas, legislaciones, inversiones
e innovación es fundamental para un progreso acelerado.
Juntas, las personas pueden generar un cambio.

|
Se llama cáncer y es uno de nuestros peores enemigos. Se
presenta de improviso, como el amigo que no llama para dejarse
caer por casa. Una radiografía con una mancha extraña, una
analítica con valores inesperados. El tiempo que transcurre
entre la duda y la certeza, el suficiente para que se quite
la máscara. Y diga: "aquí estoy, he venido para quedarme".
Es entonces cuando empieza la lucha contra el cáncer. La batalla
sin tregua. El cáncer, el maldito cáncer, el que se ha llevado
a algunos de nuestros amigos y familiares más queridos. El
cáncer, el maldito cáncer, el mismo al que han sobrevivido
tantos otros. La historia de la humanidad también ha sido
una pelea contra el tiempo, una lucha para entender, desentrañar,
descubrir y curar esta enfermedad.
¿Desde cuándo sabemos que existe el cáncer? Hay quien dice
que esta enfermedad es tan vieja como la humanidad. Razón
no les falta. Los primeros casos clínicos se encontraron en
el papiro de Edwin Smith, un documento histórico que recogió
en 1.600 a.C. algunos detalles sobre esta enfermedad.

Perteneciente a la época de la dinastía XVII,
fue hallado y adquirido por el comerciante Edwin Smith en
1862. Actualmente se encuentra expuesto en la Academia de
Medicina de Nueva York, aunque no es el único vestigio egipcio
en el que se describe el cáncer. También el papiro George
Ebers, considerado como uno de los tratados médicos más antiguos,
recopila algunos detalles sobre posibles casos de cáncer de
mama y cáncer de útero.
Si hay un personaje clave en la historia de
la medicina, es sin duda Hipócrates. El griego fue el primero
en utilizar el término 'karkínos' para referirse a 'úlcera
maligna' o 'cáncer'. Es curioso, ya que de este concepto también
deriva la palabra 'cangrejo'. Algunos historiadores atribuyen
esta similitud entre cangrejo y cáncer a que "los tumores
son tan duros como un caparazón". El cáncer también es una
enfermedad tenaz, que logra cambiar de localización en el
organismo. Incluso algunos casos de cáncer de mama presentan
una apariencia similar a las patas de un cangrejo. La mitología
griega también recoge el concepto del cangrejo. En la lucha
de Heracles contra la Hidra de Lerna, el héroe consigue zafarse
del cangrejo enviado por Hera para que le mordiera los pies
y le estorbara en la pelea. No consiguió matarle, sino que
pudo sobrevivir al ataque del 'karkínos'. Hoy en día observamos
esta batalla en un lécito conservado en el Museo del Louvre
en París.
En el Día Mundial del Cáncer se habla mucho
de los avances en los tratamientos y terapias contra esta
enfermedad. Pero lo cierto es que esta pelea se extiende en
el tiempo hasta la propia Edad Media. Como ejemplo podemos
destacar a Clara Jacobi, una mujer que padecía un enorme tumor
en la cabeza. En pleno 1689, y con las rudimentarias técnicas
de la época, consiguieron extirpar quirúrgicamente la masa
que había crecido en el cuello de esta holandesa.

Tendría que pasar un siglo hasta que se comprendiera
cómo podía realizarse la extirpación quirúrgica de un tumor.
En el caso de Jacobi, era más sencillo extraer la masa visible.
¿Pero qué ocurría si los tumores se localizaban dentro del
organismo? Las bases científicas las determinó primero Giovanni
Battista Morgagni, un médico italiano que cambió para siempre
la anatomía patológica. Comenzó a realizar autopsias de una
forma más cuidadosa, mejorando el diagnóstico de muchas enfermedades.

Tras el trabajo de Morgagni, el cirujano escocés
John Hunter sugirió que el cáncer podía ser "removido" del
organismo. Tal y como sucedió con Jacobi, Hunter planteaba
que las masas tumorales que se desarrollaban en el interior
del cuerpo también tenían que ser extirpadas. Su libro puede
ser hoy consultado online a través del archivo de los Institutos
Nacionales de Salud (NIH) de Estados Unidos.

¿Por qué ocurre el cáncer? Esta pregunta es
a menudo planteada por pacientes y familiares. Hasta el siglo
XIX, la medicina se había esforzado en conocer dónde aparecían
las masas tumorales y saber cómo poder eliminarlas del organismo.
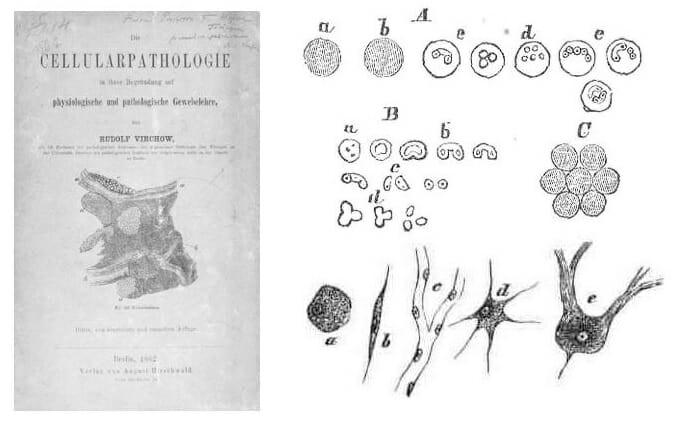
Pero fue Rudolf Virchow el que comprendió por primera vez
que la raíz del cáncer se encontraba en nuestras propias células.
En 1858, escribió en Diecellulare Pathologie que las bases
de cualquier enfermedad debían estudiarse y entenderse a nivel
celular. También las del cáncer. Hoy en día su trabajo sigue
siendo fundamental: gran parte de la investigación se centra
en comprender qué errores ocurren en nuestras células para
que se origine un tumor.
¿Quién diría que las contiendas nos permiten
lograr avances médicos? Lo cierto es que la ciencia en guerra
se ha desarrollado en tiempos muy difíciles, consiguiendo
inesperados beneficios. Uno de los más destacados es, sin
duda, la llegada de la quimioterapia. Durante la I Guerra
Mundial, cientos de soldados sufrían los efectos del temido
gas mostaza. Este agente químico, utilizado por primera vez
por el ejército alemán en la ciudad de Ypres, era capaz de
destruir la médula ósea. En 1942, científicos de la Universidad
de Yale decidieron investigar el por qué. Comprobaron que
el gas mostaza era un compuesto alquilante, capaz de modificar
el ADN de nuestras células. Estudios posteriores derivaron
en el desarrollo de fármacos quimioterápicos como el clorambucilo,
el melfalán o el busulfán, ampliamente usados en el tratamiento
de leucemias, linfoma o mieloma. Había nacido la quimioterapia.

Desarrollando la quimioterapia en la Universidad
de Yale.
Gordon Isaacs tenía sólo siete meses cuando
su madre le llevó al pediatra. La revisión médica no levantó
sospechas, pero Helen sentía que algo no iba bien. Notaba
que en la mirada de su hijo había algo extraño. Sus sospechas
eran ciertas. En 1955, un oftalmólogo descubrió que el niño
sufría retinoblastoma doble en ambos ojos, un tipo de tumor
infantil en el que las células malignas afectan a los tejidos
de la retina.
Los tratamientos existentes resultaban completamente
amenazadores. Podían optar por extirpar quirúrgicamente el
tumor, lo que dañaría para siempre la vista del bebé. Tal
vez deberían probar con radiación de cobalto. Ninguna de las
soluciones parecía remediar el problema que sufría el pequeño
Gordon. Entonces llegó el visionario Henry Kaplan, un médico
pionero en el campo de la radiobiología. Kaplan decidió emplear
aceleradores lineales que podían atacar a los tumores de Gordon,
minimizando el daño de los tejidos no afectados. Había un
único problema: jamás habían sido usados en un paciente real.
Menos en un bebé. Helen decidió aceptar la propuesta del médico,
que conllevaría la hospitalización durante seis semanas, en
las que el niño tendría que ser anestesiado a diario para
recibir su dosis. Así ocurrió el nacimiento de la radioterapia,
que luego sería aplicada con éxito por Kaplan en el tratamiento
del linfoma de Hodgkin.

| Sucedió en 1970. El presidente Richard Nixon anunciaba
la prohibición de los anuncios de tabaco en radio y televisión.
La medida era la respuesta -tardía- a un informe presentado
seis años antes por Luther Terry en una histórica conferencia
de prensa. En aquella rueda los resultados del documento
Report on Smoking and Health eran claros: el tabaco producía
cáncer. Las primeras sospechas sobre el tabaco se dispararon
en 1939. Algunos científicos comenzaron a alertar de que
el tabaco podía ser un potente agente carcinógeno, pero
las presiones de la industria tabacalera fueron demasiado
fuertes. Hoy en día sabemos que el hábito de fumar es
responsable del 90% de los casos de cáncer de pulmón.
Para algunos, por desgracia, esta estadística llega demasiado
tarde. |
El mismo año en el que moría de cáncer Alfred
S. Bloomingdale, inventor de las tarjetas de crédito, el gobierno
de Estados Unidos informaba a los habitantes de Times Beach
(Missouri) que su ciudad estaba contaminada por unos tóxicos
ambientales. Como consecuencia, la localidad debía ser evacuada
y demolida de manera urgente.
Times Beach se convirtió así en un símbolo de
los efectos ambientales en nuestra salud. Los tóxicos culpables
eran dioxinas, que habían sido vertidas en carreteras sin
pavimentar de la zona. Hoy en día la Organización Mundial
de la Salud reconoce la elevada toxicidad de estos compuestos
químicos, que despoblaron esta región de Estados Unidos.

La lucha contra el cáncer no ha estado exenta
de dificultades. Tal vez quien mejor represente estos obstáculos
sea Terry Fox, el deportista canadiense que encabezó la maratón
por la esperanza. A la temprana edad de 19 años, Fox fue diagnosticado
con osteosarcoma, un tumor maligno que afectaba a su rodilla.
Los médicos no pudieron hacer más que amputarle la pierna,
para luego aplicarle un tratamiento a base de quimioterapia.
Terry Fox supo que la administración de quimioterápicos
le permitía tener un 50% de posibilidades más de vencer al
cáncer. Pero ése no era el porcentaje más sorprendente. Sólo
dos años antes, sus oportunidades se reducían al 15%. Ahí
fue donde el atleta comprendió la importancia de la investigación
contra el cáncer. Con el objetivo de recaudar fondos para
la ciencia, en 1980 comenzó a cruzar Canadá de punta a punta.
En total recorrió 5.373 kilómetros en 143 días.
Su maratón para la esperanza recaudó en la época 1,7 millones
de dólares. Fox había vencido, mostrando lo importante que
era financiar la investigación de esta enfermedad. Por desgracia,
no pudo ganar su batalla personal. En 1981, fallecía por complicaciones
del cáncer. Terry Fox se convertía en un verdadero símbolo,
y en un ejemplo de esperanza para millones de pacientes en
todo el mundo.

|
Un grupo de investigadores estadounidenses ha descubierto
una sorprendente capacidad para matar células cancerosas
en 49 fármacos ya existentes para otras patologías como
la diabetes o la inflamación. Ni en uno ni en dos ni
en tres... Un grupo de investigadores ha descubierto
una sorprendente capacidad para matar células cancerosas
en 49 fármacos ya existentes para otras patologías como
la diabetes o la inflamación. Incluso en un medicamento
para tratar la artritis en los perros. Así lo señala
un artículo que acaba de publicar la revista Nature
Cancer. Se trata del estudio más amplio realizado hasta
la fecha con la intención expresa de encontrar nuevos
usos a las pastillas de siempre. Memorable fue, por
ejemplo, cuando se constataron los beneficios de la
aspirina en el corazón o cuando al probar el sildenafilo
para la angina de pecho, por casualidad, se identificaron
las bondades que hoy dan nombre a la Viagra. En esta
ocasión, nomenclaturas como disulfiram (para el tratamiento
del alcoholismo crónico) y lovastatina (para reducir
el colesterol) se postulan como posibles opciones contra
los tumores en un futuro no muy lejano. Antes, subrayan
los propios autores del trabajo, del Instituto Broad
del MIT Massachusetts, Estados Unidos), "habrá que realizar
más análisis sobre estos 49 medicamentos no oncológicos
y después llevarlos a ensayos clínicos para probarlos
en pacientes con cáncer".
Los investigadores probaron un total de 4.518 compuestos
del Centro de Reutilización de Medicamentos de Broad
en 578 líneas celulares de cáncer humano. Utilizando
un método de código de barras molecular conocido como
PRISM, que se desarrolló en el laboratorio Golub, se
pudieron etiquetar cada una de las líneas celulares
con un código de barras de ADN y medir la tasa de supervivencia
de las células cancerosas.
El resultado: ni más ni menos que 49 medicamentos indicados
y comercializados para otras patologías como la diabetes
mostraron una sorprendente capacidad para matar a las
células cancerosas. Es decir, no sólo funcionan para
reducir el colesterol, la inflamación o la artritis.
También parecen tener potencial antitumoral. "Pensábamos
que seríamos afortunados si encontrábamos un solo compuesto
con estas propiedades", reconoce Todd Golub, director
científico del trabajo y del programa de cáncer en Broad.
Así como la mayoría de los medicamentos contra el cáncer
bloquean las proteínas, argumenta Corsello, "estamos
descubriendo que los compuestos pueden actuar a través
de otros mecanismos como la activación de una proteína
o estabilizando la interacción entre proteínas". No
obstante, la mayoría de estos medicamentos no oncológicos
mostraron actividad contra el tumor al relacionarse
con un objetivo molecular previamente no reconocido.
Por ejemplo, el medicamento antiinflamatorio tepoxalina,
desarrollado originalmente para su uso en personas pero
aprobado para el tratamiento de la osteoartritis en
perros, eliminó las células cancerosas al golpear un
objetivo desconocido en las células que sobreexpresan
la proteína MDR1, que comúnmente impulsa la resistencia
a los medicamentos de quimioterapia.
Disulfiram y lovastatina, dos de los fármacos
con potencial anti tumoral identificados.
En los últimos años se ha intensificado la búsqueda
de nuevas indicaciones para fármacos ya comercializados.
Por un lado, se acortan los tiempos, ya que no hay que
desarrollar la medicina empezando desde cero. Cabe recordar
que desde el descubrimiento de una molécula hasta su
llegada al mercado pueden pasar 10 años. Por otro lado,
supondría un abaratamiento de los costes. Según los
últimos datos, la investigación y el desarrollo de un
fármaco supone una inversión de más de dos mil millones
de euros. Además, ahora existe tecnología punta que
ayuda a procesar y analizar millones y millones de datos
que a su vez conectan entre sí hasta dar con la diana,
en este caso, hallando una nueva indicación para una
medicina antigua. Con este objetivo, "creamos el Centro
de Reutilización de Medicamentos de Broad, que tiene
ahora un almacén de más de 6.000 compuestos aprobados
por la Agencia Americana del Medicamento (FDA, por sus
siglas en inglés) o que han demostrado ser seguros en
ensayos clínicos", señala Steven Corsello, el primer
firmante del estudio y oncólogo del Instituto Broad
en Cambridge, Massachusetts.
Los resultados de este estudio "abren nuevas puertas
para analizar muchísimos fármacos en otros modelos.
No es lo mismo una línea celular que una persona. Habrá
que estudiar las dosis necesarias, la toxicidad, la
seguridad...", apunta Enriqueta Felip, vicepresidenta
de la Sociedad Española de Oncología Médica (SEOM) y
jefe de Sección del Servicio de Oncología Médica del
Hospital Universitario Vall d'Hebron de Barcelona. Sin
duda, "este grupo de científicos es muy potente, su
trabajo es muy extenso y lo comparten abiertamente.
Al trabajar con fármcos que ya existen, tenemos mucho
ganado". Además de estos hallazgos, Corsello y su equipo
también revelaron nuevos mecanismos y objetivos farmacológicos,
lo que podría acelerar el desarrollo de nuevos medicamentos
contra el cáncer o reutilizar los medicamentos existentes
para tratar esta enfermedad. De momento, los investigadores
estudiarán los compuestos en más líneas celulares de
cáncer y su intención también incluye ampliar el número
de compuestos.
|
--------------------------------------------------------------------------------------------------------------



--------------------------------------------------------------------------------------------------------------

--------------------------------------------------------------------------------------------------------------
|
